Échographie du thorax fœtal : De l’anatomie normale aux malformations complexes
Demo

Demo
Ce cours, d’une durée de deux heures, vise à fournir aux participants une approche complète et structurée de l’échographie du thorax fœtal, allant de l’anatomie normale aux malformations les plus complexes.
Dans un premier temps, nous aborderons les bases de l’échographie thoracique, en détaillant les techniques d’imagerie utilisées, les coupes échographiques essentielles et les critères d’évaluation des structures thoraciques normales. Cette compréhension de l’anatomie normale est indispensable pour identifier toute anomalie et en évaluer la sévérité.
Nous explorerons ensuite les principales malformations congénitales, notamment la hernie diaphragmatique congénitale (HDC) et les malformations pulmonaires congénitales telles que la maladie adénomatoïde kystique pulmonaire (MAKP) et la séquestration pulmonaire.
L’accent sera mis sur les signes échographiques distinctifs, les outils pronostiques comme le Lung-to-Head Ratio (LHR) et les options thérapeutiques disponibles, y compris les interventions prénatales comme l’occlusion trachéale fœtoscopique (FETO).
D’autres pathologies thoraciques, comme les épanchements pleuraux, les masses médiastinales et les anomalies du diaphragme, seront également abordées.
Enfin, nous discuterons des implications cliniques et de la prise en charge multidisciplinaire, en mettant l’accent sur la surveillance échographique, les décisions obstétricales, la réanimation néonatale et les interventions postnatales.
Plan du cours
- Présentation des objectifs du cours
- Importance de l’échographie pour l’étude du thorax fœtal
- Techniques et principes de base de l’échographie thoracique fœtale
- Structures principales à analyser en échographie :
- Poumons
- Diaphragme
- Cœur et médiastin
- Cage thoracique et côtes
- Coupes échographiques essentielles :
- Axiale
- Parasagittale
- Signes échographiques d’un développement pulmonaire normal
- Techniques d’imagerie :
- Mode 2D
- Doppler couleur
- Mode 3D (si applicable)
- Importance des mesures quantitatives :
- Lung-to-Head Ratio (LHR)
- Volume pulmonaire mesuré en IRM
4.1. Hernie diaphragmatique congénitale (HCD) (15 min)
- Physiopathologie et incidence
- Signes échographiques :
- Déplacement du cœur
- Position anormale de l’estomac et du foie
- Outils pronostiques :
- LHR observé/attendu
- Position du foie et de l’estomac
4.2. Malformations pulmonaires congénitales (15 min)
- Maladie adénomatoïde kystique pulmonaire (MAKP)
- Séquestration pulmonaire
- Atrésie bronchique
- Imagerie et différenciation échographique
- Chylothorax congénital
- Effusions pleurales
- Masses médiastinales (kystes bronchogéniques, tératomes)
- Importance du diagnostic prénatal
- Surveillance échographique des cas à risque
- Approche multidisciplinaire et implications obstétricales
- Options thérapeutiques in utero (ex. occlusion trachéale pour HCD)
- Synthèse des points clés du cours
- Perspectives futures et développement des techniques d’imagerie
- Questions et échanges avec les participants
développement des chapitres du plan
1.1. Objectifs du chapitre (2 min)
- Comprendre l’intérêt de l’échographie dans l’évaluation du thorax fœtal
- Identifier les indications principales de l’examen
- Appréhender les limites et les défis diagnostiques
1.2. Importance de l’échographie thoracique fœtale en médecine prénatale (3 min)
- Rôle clé du diagnostic prénatal
- Détection des anomalies pulmonaires et diaphragmatique
- Anticipation des complications néonatales
- Planification de la prise en charge obstétricale et postnatale
- Comparaison avec d’autres techniques d’imagerie
- IRM fœtale : complémentaire à l’échographie pour le calcul du volume pulmonaire
- Radiographie et scanner postnatals : non réalisables in utero, mais essentiels après la naissance
- Indications principales de l’échographie thoracique fœtale
- Suspicion de malformation pulmonaire (ex. hernie diaphragmatique congénitale, séquestration pulmonaire)
- Anomalie détectée lors de l’échographie morphologique systématique
- Signes d’hydrops fœtal ou d’épanchement pleural
1.3. Techniques et principes de base de l’échographie thoracique fœtale (5 min)
1.3.1. Modes d’imagerie utilisés
- Mode 2D (B-mode) :
- Identification des structures thoraciques normales
- Détection des masses ou des anomalies du diaphragme
- Doppler couleur et Doppler pulsé :
- Analyse des flux sanguins dans les vaisseaux pulmonaires et le cœur
- Identification d’un éventuel shunt vasculaire (ex. séquestration pulmonaire)
- Mode 3D/4D (si disponible) :
- Reconstruction volumique des poumons
- Amélioration de la visualisation des structures médiastinales
1.3.2. Coupes échographiques essentielles
- Coupe axiale standard (transversale) :
- Vue de référence pour évaluer les poumons et le cœur
- Identification de l’estomac et du foie en cas de suspicion de hernie diaphragmatique
- Coupes longitudinales parasagittales :
- Évaluation de la continuité du diaphragme
- Vérification de l’emplacement des organes abdominaux
- Coupes coronalement orientées :
- Appréciation de la symétrie pulmonaire
- Détection des épanchements pleuraux
1.3.3. Repères anatomiques clés en échographie thoracique fœtale
- Le cœur et son positionnement : évaluation du situs et du déplacement éventuel
- Le diaphragme : présence, continuité et concavité
- Les poumons : homogénéité, volume et vascularisation
- Le médiastin : déviation, compression des structures environnantes
1.4. Limites et défis diagnostiques (2 min)
- Facteurs influençant la qualité de l’image échographique :
- Position fœtale défavorable
- Oligohydramnios réduisant la fenêtre acoustique
- Obésité maternelle compliquant la transmission des ultrasons
- Problèmes d’interprétation possibles :
- Confusion entre certaines malformations (ex. séquestration pulmonaire vs. maladie adénomatoïde kystique pulmonaire)
- Estimation difficile du pronostic en cas de lésions complexes
- Complémentarité avec l’IRM fœtale :
- Précision accrue pour le volume pulmonaire et la différenciation tissulaire
- Meilleure évaluation des structures médiastinales
2.1. Introduction et objectifs du chapitre (2 min)
- Comprendre l’organisation anatomique du thorax fœtal
- Apprendre à identifier les structures thoraciques normales en échographie
- Savoir différencier un développement pulmonaire normal d’un développement pathologique
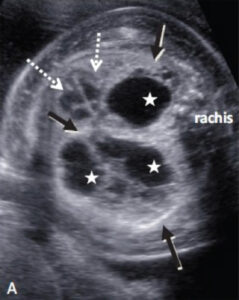
2.2. Structures principales à analyser en échographie thoracique fœtale (5 min)
2.2.1. Poumons fœtaux
- Développement embryologique et phases de maturation :
- Phase pseudoglandulaire (5-17 SA)
- Phase canaliculaire (16-26 SA)
- Phase sacculaire (24-36 SA)
- Phase alvéolaire (à partir de 36 SA)
- Aspect échographique normal :
- Échogénicité homogène au 2e trimestre
- Augmentation progressive de l’échogénicité au 3e trimestre
- Symétrie des poumons droit et gauche
2.2.2. Diaphragme
- Structure musculo-tendineuse séparant le thorax et l’abdomen
- Critères échographiques d’un diaphragme normal :
- Ligne hyperéchogène continue
- Concavité dirigée vers l’abdomen
- Absence de solution de continuité
2.2.3. Cœur et médiastin
- Évaluation du positionnement cardiaque :
- Cœur situé à gauche
- Apex dirigé à 45° vers la gauche
- Structures médiastinales visibles :
- Thymus : aspect homogène et légèrement hyperechogène
- Artère pulmonaire et aorte thoracique
2.2.4. Cage thoracique et côtes
- Forme ovoïde du thorax
- Développement harmonieux des côtes
- Rôle protecteur et indicateur du bon développement pulmonaire
2.3. Coupes échographiques essentielles pour l’étude du thorax fœtal (5 min)
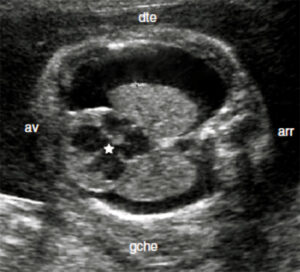
2.3.1. Coupe axiale standard (transversale)
- Vue de référence pour l’analyse du thorax
- Structures visualisées :
- Poumons symétriques
- Cœur et sa position
- Éléments du médiastin (thymus, gros vaisseaux)
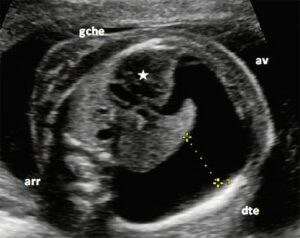
2.3.2. Coupe longitudinale parasagittale
- Permet d’examiner :
- La continuité du diaphragme
- L’intégrité des poumons et leur rapport avec l’abdomen
2.3.3. Coupe coronale
- Intérêt dans l’évaluation des épanchements pleuraux
- Permet d’observer la symétrie des poumons
2.4. Signes échographiques d’un développement pulmonaire normal (3 min)
- Évaluation du volume pulmonaire :
- Poumons occupent environ 1/3 de la cavité thoracique
- Absence de compression ou de déplacement médiastinal
- Lung-to-Head Ratio (LHR) :
- Utilisé pour évaluer les cas de hernie diaphragmatique congénitale
- LHR normal > 1.0
- Doppler des artères pulmonaires :
- Débit sanguin homogène et symétrique
2.5. Conclusion et transition vers le chapitre suivant (1 min)
- Importance de connaître l’anatomie normale pour détecter les anomalies
- Transition vers les techniques d’évaluation avancées pour affiner le diagnostic échographique
3.1. Introduction et objectifs du chapitre (2 min)
- Comprendre les différentes techniques d’imagerie échographique appliquées au thorax fœtal
- Savoir adapter la méthode d’évaluation en fonction du contexte clinique
- Identifier les outils permettant d’affiner le diagnostic
3.2. Modes d’imagerie utilisés en échographie thoracique fœtale (6 min)
3.2.1. Mode 2D (B-mode) : analyse morphologique de base (2 min)
- Mode principal pour l’évaluation du thorax
- Permet d’évaluer :
- La symétrie pulmonaire
- La position et la taille du cœur
- La continuité et la concavité du diaphragme
- L’existence d’épanchements pleuraux ou d’images anormales
- Points d’attention :
- Qualité de l’image influencée par la position fœtale et la quantité de liquide amniotique
- Limites en cas d’oligohydramnios
3.2.2. Doppler couleur et Doppler pulsé : analyse vasculaire (2 min)
- Identification des flux sanguins :
- Vascularisation pulmonaire : artères et veines pulmonaires
- Cœur et gros vaisseaux : évaluation des connections normales et des shunts anormaux
- Détection d’une séquestration pulmonaire par mise en évidence d’une artère systémique anormale
- Paramètres évalués en Doppler pulsé :
- Indice de résistance des artères pulmonaires
- Flux dans la veine cave inférieure et le canal veineux pour évaluer une éventuelle insuffisance cardiaque
3.2.3. Mode 3D/4D : application avancée (2 min)
- Utilisation en complément du mode 2D pour :
- Reconstruction volumique des poumons
- Analyse détaillée des structures médiastinales
- Différenciation entre lésions kystiques et solides
- Avantages :
- Amélioration de la visualisation des structures complexes
- Permet une évaluation plus précise de l’hypoplasie pulmonaire
3.3. Coupes échographiques essentielles pour l’évaluation thoracique (4 min)
3.3.1. Coupe axiale standard (2 min)
- Vue de référence pour l’analyse thoracique
- Structures visibles :
- Poumons symétriques : homogénéité de l’échogénicité
- Cœur : position normale avec apex pointant à gauche
- Diaphragme : continuité et concavité
- Applications diagnostiques :
- Détection d’une hernie diaphragmatique congénitale
- Identification de lésions pulmonaires kystiques ou solides
3.3.2. Coupe longitudinale parasagittale (1 min)
- Intérêt pour l’étude du diaphragme
- Vérification du contenu abdominal et de sa position
- Utilisée en cas de suspicion de hernie diaphragmatique
3.3.3. Coupe coronale (1 min)
- Permet d’évaluer la symétrie thoracique
- Détection des épanchements pleuraux et anomalies médiastinales
3.4. Importance des mesures quantitatives (3 min)
3.4.1. Lung-to-Head Ratio (LHR)
- Calculé en cas de suspicion de hernie diaphragmatique congénitale
- LHR = Surface pulmonaire controlatérale / Périmètre céphalique
- Valeurs seuils :
- LHR > 1.0 : bon pronostic
- LHR < 1.0 : risque accru d’hypoplasie pulmonaire
3.4.2. Volume pulmonaire mesuré en IRM
- Utilisé pour affiner l’évaluation de l’hypoplasie pulmonaire
- Observed-to-Expected Total Fetal Lung Volume (O/E-TFLV)
- Meilleur prédicteur du pronostic néonatal en cas de malformations pulmonaires
3.4.3. Évaluation du rapport thorax-abdomen
- Un rapport thoracique trop réduit peut indiquer une hypoplasie pulmonaire sévère
3.5. Conclusion et transition vers le chapitre suivant (1 min)
- Importance d’une approche multimodale (2D, Doppler, 3D) pour un diagnostic optimal
- Transition vers l’évaluation des malformations thoraciques congénitales
4.1. Introduction et objectifs du chapitre (2 min)
- Définir les principales malformations thoraciques congénitales détectables en échographie
- Comprendre l’impact de ces malformations sur la croissance pulmonaire et la survie néonatale
- Identifier les critères échographiques permettant de différencier ces anomalies
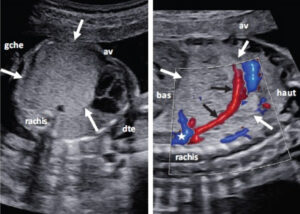
4.2. Hernie diaphragmatique congénitale (HDC) (15 min)
4.2.1. Définition et physiopathologie (2 min)
- Défaut de fermeture du diaphragme entraînant la migration des organes abdominaux dans le thorax
- Incidence : 1/3 500 naissances
- Types de HDC :
- Hernie de Bochdalek (95%) : postéro-latérale gauche
- Hernie de Morgagni (5%) : antérieure droite
4.2.2. Signes échographiques de la HDC (4 min)
- Déplacement du cœur vers le côté opposé
- Absence de visualisation de la coupole diaphragmatique
- Présence d’organes abdominaux dans le thorax :
- Estomac intrathoracique (HDC gauche)
- Foie intrathoracique (HDC droite)
- Hydramnios associé (en raison de la compression de l’œsophage)
4.2.3. Outils pronostiques en cas de HDC (5 min)
- Lung-to-Head Ratio (LHR) : évaluation du développement pulmonaire
- LHR observé/attendu (O/E-LHR) :
- >45% : bon pronostic
- 25-45% : pronostic intermédiaire
- <25% : pronostic sévère
- Position du foie : facteur prédictif majeur
- Foie intra-abdominal : meilleur pronostic
- Foie intrathoracique : risque accru d’hypoplasie pulmonaire
- Volume pulmonaire en IRM
- O/E-TFLV (Observed-to-Expected Total Fetal Lung Volume) :
- Corrélation avec le taux de survie
- Permet une meilleure évaluation de la gravité de l’hypoplasie pulmonaire
4.2.4. Options thérapeutiques et prise en charge (4 min)
- Suivi échographique régulier
- Fetoscopic Endoluminal Tracheal Occlusion (FETO) en cas de LHR très bas
- Accouchement en centre de niveau III avec équipe spécialisée en chirurgie néonatale
- Chirurgie postnatale après stabilisation du nouveau-né
4.3. Malformations pulmonaires congénitales (15 min)
4.3.1. Maladie adénomatoïde kystique pulmonaire (MAKP) (5 min)
- Définition et classification
- Malformation kystique due à une prolifération anormale du tissu pulmonaire
- Classification de Stocker :
- Type I : macrokystique (≥ 5 mm)
- Type II : microkystique (< 5 mm)
- Type III : massif, échogène
- Signes échographiques
- Masse pulmonaire hyperéchogène unilatérale
- Présence de kystes (variable selon le type)
- Déviation du médiastin possible en cas de lésion volumineuse
- Hydramnios en cas de compression œsophagienne
- Pronostic et prise en charge
- Régression spontanée possible au 3ᵉ trimestre
- Chirurgie postnatale si lésions symptomatiques ou volumineuses
4.3.2. Séquestration pulmonaire (5 min)
- Définition et classification
- Tissu pulmonaire non fonctionnel alimenté par une circulation systémique anormale
- Types :
- Séquestration intralobaire : absence de plèvre propre, drainée par le système pulmonaire
- Séquestration extralobaire : plèvre propre, drainée par la circulation systémique
- Signes échographiques
- Masse pulmonaire hyperéchogène bien délimitée
- Visualisation d’un vaisseau anormal à l’échographie Doppler
- Absence de connexion avec l’arbre bronchique
- Pronostic et prise en charge
- Surveillance prénatale si absence de complications
- Chirurgie postnatale si complications respiratoires
4.3.3. Atrésie bronchique (5 min)
- Définition et mécanisme
- Obstruction congénitale d’une bronche proximale
- Accumulation de liquide en aval entraînant une distension pulmonaire
- Signes échographiques
- Masse pulmonaire hyperéchogène
- Dilatation des bronchioles distales
- Déviation du médiastin en cas de volumineuse lésion
- Prise en charge
- Surveillance prénatale si asymptomatique
- Chirurgie postnatale si détresse respiratoire
4.4. Conclusion et transition vers le chapitre suivant (2 min)
- Importance du diagnostic différentiel entre les malformations thoraciques
- Lien entre imagerie prénatale et prise en charge postnatale
- Transition vers le chapitre 5 : Autres pathologies thoraciques fœtales
5.1. Introduction et objectifs du chapitre (2 min)
- Identifier les pathologies thoraciques fœtales autres que la hernie diaphragmatique et les malformations pulmonaires congénitales
- Comprendre les signes échographiques permettant de les diagnostiquer
- Expliquer l’impact de ces anomalies sur le développement fœtal et leur prise en charge
5.2. Chylothorax congénital (5 min)
5.2.1. Définition et physiopathologie (1 min)
- Épanchement pleural lymphatique secondaire à une fuite du canal thoracique
- Incidence : environ 1/10 000 naissances
- Formes :
- Idiopathique (primitif) : anomalie isolée
- Secondaire : lié à une anomalie chromosomique (ex. syndrome de Noonan), une infection ou une malformation lymphatique
5.2.2. Signes échographiques (2 min)
- Présence d’un épanchement pleural anéchogène
- Unilatéral (25% des cas) ou bilatéral (75%)
- Compression pulmonaire entraînant une hypoplasie pulmonaire si sévère
- Possible association avec un hydrops fœtal
5.2.3. Pronostic et prise en charge (2 min)
- Surveillance échographique de l’évolution de l’épanchement
- Ponction pleurale fœtale (thoracocentèse) en cas d’anasarque
- Shunt pleuro-amniotique en cas de récidive
- Prise en charge néonatale avec ventilation assistée si détresse respiratoire
5.3. Effusions pleurales non chylothoraciques (3 min)
5.3.1. Causes principales (1 min)
- Hydrops fœtal non immune
- Infections congénitales (CMV, parvovirus B19)
- Malformations cardiaques congénitales
- Tumeurs médiastinales
5.3.2. Signes échographiques (1 min)
- Présence de liquide pleural isolé ou associé à un hydramnios
- Compression pulmonaire variable selon la quantité d’épanchement
- Évaluation de l’évolution et du retentissement sur le cœur et les poumons
5.3.3. Prise en charge (1 min)
- Surveillance prénatale par échographie régulière
- Traitement étiologique postnatal selon la cause sous-jacente
- Possibilité de drainage postnatal en cas d’impact respiratoire
5.4. Masses médiastinales fœtales (5 min)
5.4.1. Tératome médiastinal (2 min)
- Définition : tumeur bénigne contenant des tissus de différentes origines embryonnaires
- Signes échographiques :
- Masse hétérogène médiastinale avec composante kystique et solide
- Déplacement du cœur et compression pulmonaire
- Présence éventuelle de calcifications
- Pronostic et prise en charge :
- Risque de complications cardiovasculaires par compression des gros vaisseaux
- Chirurgie postnatale nécessaire dans la majorité des cas
5.4.2. Kyste bronchogénique (1 min)
- Définition : malformation congénitale due à une anomalie du développement de l’arbre trachéobronchique
- Signes échographiques :
- Image kystique anéchogène proche de la trachée ou des bronches principales
- Absence de vascularisation interne
- Pronostic et prise en charge :
- Surveillance prénatale
- Exérèse chirurgicale postnatale si risque de compression des voies respiratoires
5.4.3. Séquestration médiastinale (1 min)
- Définition : tissu pulmonaire non fonctionnel situé dans le médiastin
- Signes échographiques :
- Masse hyperéchogène médiastinale
- Mise en évidence d’un vaisseau systémique anormal en Doppler couleur
- Pronostic et prise en charge :
- Exérèse chirurgicale postnatale si complications
5.5. Pathologies du diaphragme (3 min)
5.5.1. Agénésie diaphragmatique (1 min)
- Absence totale du diaphragme entraînant une ascension massive des organes abdominaux
- Signes échographiques :
- Non-visualisation du diaphragme
- Déplacement important du cœur et des poumons
- Pronostic très sombre avec décès néonatal fréquent
5.5.2. Paralysie diaphragmatique (1 min)
- Origine : atteinte du nerf phrénique
- Signes échographiques :
- Mouvement paradoxal du diaphragme en mode M
- Position anormalement haute du diaphragme
- Prise en charge :
- Surveillance prénatale
- Assistance respiratoire néonatale si détresse respiratoire
5.5.3. Hernie de Morgagni (1 min)
- Définition : défaut antérieur du diaphragme avec passage d’organes abdominaux dans le thorax
- Signes échographiques :
- Image anéchogène antérieure avec contenu digestif
- Absence de déplacement médiastinal important
- Pronostic et prise en charge :
- Correction chirurgicale postnatale dans les premiers mois de vie
5.6. Conclusion et transition vers le chapitre suivant (2 min)
- Récapitulation des pathologies thoraciques rares
- Importance du diagnostic différentiel et du suivi prénatal adapté
- Transition vers le chapitre 6 sur les implications cliniques et la prise en charge
6.1. Introduction et objectifs du chapitre (2 min)
- Comprendre l’impact des anomalies thoraciques fœtales sur la gestion de la grossesse et de l’accouchement
- Identifier les stratégies de surveillance prénatale et les options thérapeutiques disponibles
- Expliquer l’organisation de la prise en charge postnatale et les perspectives à long terme
6.2. Importance du diagnostic prénatal et du suivi échographique (4 min)
6.2.1. Détection précoce et classification des anomalies (2 min)
- Identification des anomalies dès la 2ᵉ échographie morphologique (22 SA)
- Classification des anomalies thoraciques en fonction de :
- Leur impact sur le développement pulmonaire
- Leur association à d’autres malformations congénitales
- Leur évolution potentielle pendant la grossesse
6.2.2. Surveillance échographique des cas à risque (2 min)
- Critères de suivi rapproché :
- Volume pulmonaire réduit
- Signes d’hydrops fœtal
- Déplacement médiastinal sévère
- Fréquence des contrôles échographiques :
- Tous les 15 jours en cas d’aggravation possible
- Mensuel en absence de complications
6.3. Approche multidisciplinaire pour l’orientation de la prise en charge (4 min)
6.3.1. Coordination des spécialistes impliqués (2 min)
- Obstétriciens spécialisés en médecine fœtale
- Radiologues et échographistes spécialisés
- Chirurgiens pédiatriques pour la planification postnatale
- Pédiatres en soins intensifs néonatals
6.3.2. Centres de référence pour les malformations congénitales (2 min)
- Critères d’orientation vers un centre spécialisé :
- Malformations sévères nécessitant une intervention néonatale immédiate
- Présence d’hydrops fœtal ou détresse respiratoire anticipée
- Besoin d’une chirurgie dans les premiers jours de vie
6.4. Options thérapeutiques prénatales et leur indication (6 min)
6.4.1. Thérapies in utero pour les pathologies sévères (3 min)
- Thoracocentèse et shunt pleuro-amniotique
- Indiqué en cas de chylothorax sévère avec compression pulmonaire
- Objectif : évacuer l’épanchement pleural et permettre l’expansion pulmonaire
- Procédure :
- Ponction échoguidée du liquide pleural
- Mise en place d’un shunt pleuro-amniotique si récidive
- Occlusion trachéale fœtoscopique (FETO) pour HDC sévère
- Réservé aux cas de hernie diaphragmatique avec LHR < 25%
- Objectif : favoriser la croissance pulmonaire en bloquant l’évacuation du liquide pulmonaire
- Procédure : insertion d’un ballon dans la trachée fœtale à 26-30 SA, retiré avant la naissance
6.4.2. Indications d’une extraction néonatale anticipée (3 min)
- Critères d’accouchement prématuré planifié :
- Hydrops fœtal évolutif
- Insuffisance cardiaque fœtale
- Voie d’accouchement privilégiée :
- Césarienne programmée en cas de masse médiastinale compressive
- Accouchement par voie basse possible si absence de détresse fœtale
6.5. Prise en charge néonatale et suivi à long terme (4 min)
6.5.1. Réanimation et soins intensifs après la naissance (2 min)
- Prise en charge immédiate en salle d’accouchement :
- Intubation rapide en cas de détresse respiratoire
- Ventilation non invasive ou oxygénothérapie selon le degré d’hypoplasie pulmonaire
- Transfert en unité de soins intensifs néonatals (USIN)
- Monitoring des fonctions respiratoires et hémodynamiques
- Préparation à la chirurgie néonatale si nécessaire
6.5.2. Stratégies chirurgicales et post-opératoires (1 min)
- Correction chirurgicale de la hernie diaphragmatique dans les premiers jours de vie
- Résection des masses pulmonaires (MAKP, séquestration) en fonction de leur évolution
- Prise en charge des complications post-opératoires (infection, détresse respiratoire prolongée)
6.5.3. Suivi à long terme et évaluation du développement pulmonaire (1 min)
- Consultations de suivi en pneumologie pédiatrique
- Surveillance de la fonction pulmonaire et de la croissance
- Évaluation des troubles de l’alimentation et du reflux gastro-œsophagien
- Kinésithérapie respiratoire en cas de séquelles pulmonaires
6.6. Conclusion et transition vers le chapitre final (2 min)
- Importance d’une prise en charge personnalisée en fonction de la sévérité des anomalies
- Coordination entre diagnostic prénatal, interventions fœtales et soins néonatals
- Transition vers le chapitre 7 : Conclusion générale et discussion
FAQ
✅ L’évaluation thoracique fœtale peut être faite dès la 2ᵉ échographie morphologique (22 SA) et être approfondie en cas d’anomalie détectée.
✅ Il permet de visualiser la vascularisation pulmonaire, d’identifier des anomalies comme une séquestration pulmonaire et d’évaluer les flux sanguins cardiaques.
✅ Il permet d’étudier le mouvement diaphragmatique, notamment en cas de suspicion de paralysie diaphragmatique.
✅
- Coupe axiale : permet d’évaluer les poumons, le diaphragme et la position du cœur.
- Coupe longitudinale parasagittale : utile pour analyser la continuité du diaphragme.
- Coupe coronale : donne une vue d’ensemble du thorax et des poumons.
✅ Elle permet une analyse globale du volume pulmonaire, la détection d’un déplacement médiastinal et l’identification des hernies diaphragmatiques congénitales (HDC).
✅ Les poumons sont initialement hypoéchogènes et deviennent progressivement hyperéchogènes en raison du développement des structures alvéolaires.
✅ Le Lung-to-Head Ratio (LHR) et le volume pulmonaire en IRM (O/E-TFLV) sont les principaux outils pronostiques pour l’évaluation de l’hypoplasie pulmonaire.
✅ Une réduction du volume pulmonaire, un déplacement médiastinal et un LHR inférieur à 1 sont des signes évocateurs.
✅ Déplacement du cœur vers le côté opposé, présence d’organes abdominaux (estomac, foie) dans le thorax et absence de continuité du diaphragme.
✅ La séquestration pulmonaire présente une vascularisation systémique anormale visible en Doppler, tandis que la MAKP est caractérisée par une masse kystique sans vascularisation systémique propre.
✅ Présence d’un épanchement pleural anéchogène, souvent bilatéral, pouvant provoquer une compression pulmonaire et être associé à un hydrops fœtal.
✅ Il apparaît comme une masse hétérogène contenant des éléments solides et kystiques, parfois avec des calcifications visibles.
✅ La présence d’hydrops fœtal, une croissance excessive d’une masse thoracique, un déplacement important du médiastin et une baisse du LHR.
✅ Tous les 15 jours en cas de malformation sévère, mensuellement si absence de complications évolutives.
✅ Une masse volumineuse compressive, un hydrops fœtal sévère ou une HDC majeure peuvent justifier une césarienne programmée pour optimiser la prise en charge néonatale.
✅ Elle permet d’anticiper le niveau de soins néonatals nécessaires, d’organiser une prise en charge chirurgicale précoce et de choisir le centre de naissance adapté.
✅ Elle permet une visualisation plus précise du volume pulmonaire, une meilleure différenciation des structures médiastinales et l’évaluation détaillée des anomalies diaphragmatiques.
✅ L’IRM est plus performante pour quantifier le volume pulmonaire (O/E-TFLV), mieux visualiser les structures médiastinales et détecter certains détails invisibles en échographie.
QCM
- Quels paramètres échographiques permettent d’évaluer une hypoplasie pulmonaire ?
✅ Réponses correctes : A, B, C
- A) Lung-to-Head Ratio (LHR) ✅
B) Volume pulmonaire observé/attendu (O/E-TFLV) ✅
C) Position du foie ✅
D) Index de résistance des artères pulmonaires ❌
E) Longueur fémorale ❌
- Quels sont les signes échographiques évocateurs d’une hernie diaphragmatique congénitale ?
✅ Réponses correctes : A, B, C, D
- A) Déplacement du cœur ✅
B) Présence d’organes abdominaux dans le thorax ✅
C) Absence de visualisation du diaphragme ✅
D) Hydramnios ✅
E) Poumons hyperéchogènes ❌
- Quels éléments permettent de différencier une séquestration pulmonaire d’une maladie adénomatoïde kystique pulmonaire (MAKP) ?
✅ Réponses correctes : A, B, D
- A) Présence d’une vascularisation systémique anormale en Doppler ✅
B) Absence de connexion avec l’arbre bronchique ✅
C) Présence de multiples kystes de tailles variables ❌
D) Masse hyperéchogène homogène ✅
E) Association fréquente avec une cardiomégalie ❌ - Quels sont les signes échographiques d’un chylothorax fœtal ?
✅ Réponses correctes : A, B, C, E
- A) Épanchement pleural anéchogène ✅
B) Hydrops fœtal ✅
C) Compression pulmonaire ✅
D) Présence de kystes pulmonaires ❌
E) Possible régression spontanée ✅
4. Quels sont les rôles du Doppler couleur en échographie thoracique fœtale ?
✅ Réponses correctes : A, C, D
- A) Évaluation de la vascularisation pulmonaire ✅
B) Identification des kystes pulmonaires ❌
C) Mise en évidence d’une artère systémique dans la séquestration pulmonaire ✅
D) Étude du flux dans l’artère pulmonaire ✅
E) Mesure de la taille des poumons ❌
5. Quels éléments visibles en échographie suggèrent une paralysie diaphragmatique ?
✅ Réponses correctes : A, C, D
- A) Mouvement paradoxal du diaphragme ✅
B) Hyperéchogénicité pulmonaire ❌
C) Position anormalement haute du diaphragme ✅
D) Absence de mouvement diaphragmatique ✅
E) Présence d’un épanchement pleural bilatéral ❌ - Quelles anomalies peuvent être associées à une hernie diaphragmatique congénitale ?
✅ Réponses correctes : A, B, C, E
- A) Malformations cardiaques ✅
B) Anomalies chromosomiques ✅
C) Hypoplasie pulmonaire ✅
D) Séquestration pulmonaire ❌
E) Anomalies digestives ✅
7. Quels éléments permettent de suspecter un tératome médiastinal en échographie ?
✅ Réponses correctes : A, B, D
- A) Masse médiastinale hétérogène ✅
B) Présence de calcifications ✅
C) Absence de déplacement médiastinal ❌
D) Compression cardiaque possible ✅
E) Visualisation d’un canal artériel dilaté ❌
8. Quelles structures sont visibles en coupe longitudinale parasagittale du thorax fœtal ?
✅ Réponses correctes : A, C, D
- A) Diaphragme ✅
B) Rate ❌
C) Foie ✅
D) Poumon ✅
E) Rein ❌
9. Quelles interventions prénatales peuvent être envisagées pour une pathologie thoracique fœtale ?
✅ Réponses correctes : A, C, D
- A) Thoracocentèse fœtale ✅
B) Intubation prénatale ❌
C) Mise en place d’un shunt pleuro-amniotique ✅
D) Occlusion trachéale fœtoscopique (FETO) ✅
E) Transfusion intra-utérine ❌
10. Quelles conditions peuvent être associées à un hydramnios en cas de pathologie thoracique fœtale ?
✅ Réponses correctes : A, B, D
- A) Compression de l’œsophage ✅
B) Hernie diaphragmatique ✅
C) Séquestration pulmonaire isolée ❌
D) Malformation médiastinale volumineuse ✅
E) Insuffisance rénale fœtale ❌
11. Quelles sont les principales causes d’effusion pleurale fœtale visibles en échographie ?
✅ Réponses correctes : A, B, C, D
A) Chylothorax congénital ✅
B) Hydrops fœtal ✅
C) Malformation cardiaque ✅
D) Infection congénitale (CMV, parvovirus B19) ✅
E) Atrésie de l’œsophage ❌
12. Quels sont les rôles de l’échographie dans la planification de l’accouchement en cas de pathologie thoracique fœtale ?
✅ Réponses correctes : A, B, C, E
A) Évaluation de la sévérité de l’hypoplasie pulmonaire ✅
B) Détermination du mode d’accouchement (voie basse vs césarienne) ✅
C) Décision d’un transfert vers un centre de niveau III ✅
D) Détection des anomalies chromosomiques ❌
E) Anticipation d’une ventilation néonatale immédiate ✅
13. Quels éléments doivent être analysés en cas de suspicion de pathologie diaphragmatique en échographie ?
✅ Réponses correctes : A, B, C, D
A) Position et continuité du diaphragme ✅
B) Présence d’organes abdominaux dans le thorax ✅
C) Déviation du cœur ✅
D) Évaluation du mouvement diaphragmatique en mode M ✅
E) Longueur du fémur ❌
14. Quels paramètres échographiques sont essentiels pour évaluer le pronostic d’une malformation pulmonaire congénitale ?
✅ Réponses correctes : A, B, C, D
A) Lung-to-Head Ratio (LHR) ✅
B) Volume pulmonaire observé/attendu (O/E-TFLV) ✅
C) Présence ou absence d’hydrops fœtal ✅
D) Déplacement médiastinal ✅
E) Épaisseur du placenta ❌
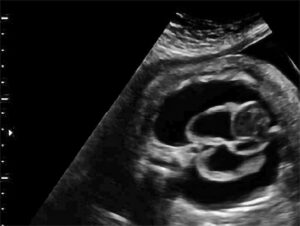
15 : Quel est le diagnostic le plus probable sur cette image échographique ?
A) Hernie diaphragmatique congénitale
B) Chylothorax fœtal
C) Atrésie de l’œsophage
D) Séquestration pulmonaire
E) Tumeur médiastinale
✅ Réponse(s) correcte(s) :
B) Chylothorax fœtal
Explication : L’image montre une coupe transverse du thorax fœtal avec un épanchement pleural bilatéral important, typique d’un chylothorax congénital.
16 : Quels sont les signes échographiques associés au chylothorax fœtal ?
A) Présence de liquide anéchogène autour des poumons
B) Déplacement médiastinal
C) Ascite fœtale associée
D) Hypoplasie pulmonaire
E) Calcifications thoraciques
✅ Réponse(s) correcte(s) :
A) Présence de liquide anéchogène autour des poumons
B) Déplacement médiastinal
C) Ascite fœtale associée
D) Hypoplasie pulmonaire
Explication : Le chylothorax se manifeste par un épanchement pleural anéchogène, pouvant entraîner un déplacement du médiastin, une ascite (si hydrops fœtal) et une hypoplasie pulmonaire en cas de compression prolongée.
17 : Quelle est la prise en charge prénatale d’un chylothorax volumineux ?
A) Surveillance échographique rapprochée
B) Ponction pleurale in utero
C) Pose d’un shunt pleuro-amniotique
D) Administration de corticoïdes pour la maturation pulmonaire
E) Transfusion intra-utérine systématique
✅ Réponse(s) correcte(s) :
A) Surveillance échographique rapprochée
B) Ponction pleurale in utero
C) Pose d’un shunt pleuro-amniotique
D) Administration de corticoïdes pour la maturation pulmonaire
Explication : La prise en charge inclut une surveillance échographique, une ponction pleurale en cas de compression sévère, et parfois la mise en place d’un shunt pleuro-amniotique si récidive. Les corticoïdes sont indiqués pour favoriser la maturation pulmonaire.
18 : Quels sont les facteurs de mauvais pronostic en cas de chylothorax congénital ?
A) Présence d’un hydrops fœtal
B) Épanchement pleural unilatéral modéré
C) Hypoplasie pulmonaire sévère
D) Association à une anomalie chromosomique
E) Amélioration spontanée du chylothorax en cours de grossesse
✅ Réponse(s) correcte(s) :
A) Présence d’un hydrops fœtal
C) Hypoplasie pulmonaire sévère
D) Association à une anomalie chromosomique
Explication : Un hydrops fœtal, une hypoplasie pulmonaire importante et une étiologie syndromique sont des facteurs de mauvais pronostic. Un épanchement modéré unilatéral ou une résolution spontanée sont des signes plutôt favorables.
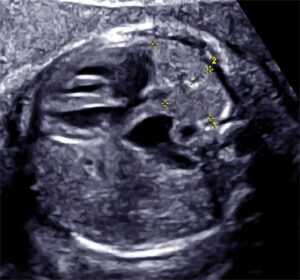
19 : Quel est le diagnostic le plus probable sur cette image échographique ?
A) Hernie diaphragmatique congénitale (HDC)
B) Chylothorax fœtal
C) Atrésie de l’œsophage
D) Séquestration pulmonaire
E) Malformation adénomatoïde kystique du poumon (CCAM)
✅ Réponse(s) correcte(s) :
A) Hernie diaphragmatique congénitale (HDC)
Explication : L’image montre une coupe axiale thoracique fœtale avec un estomac intra-thoracique, une déviation médiastinale et une anomalie du positionnement des organes abdominaux, évocateurs d’une HDC.
20 : Quels sont les signes échographiques typiques d’une hernie diaphragmatique congénitale ?
A) Déplacement du médiastin vers le côté opposé
B) Estomac et/ou anses intestinales en position thoracique
C) Hypoplasie pulmonaire du côté atteint
D) Visualisation du foie intra-thoracique dans certains cas
E) Présence d’une ascite isolée
✅ Réponse(s) correcte(s) :
A) Déplacement du médiastin vers le côté opposé
B) Estomac et/ou anses intestinales en position thoracique
C) Hypoplasie pulmonaire du côté atteint
D) Visualisation du foie intra-thoracique dans certains cas
Explication : L’HDC est caractérisée par un déplacement du médiastin et une montée des structures digestives dans le thorax. Elle peut être gauche (plus fréquente) ou droite, avec parfois une herniation du foie. Une ascite isolée n’est pas un signe spécifique.
21 : Quelle est la méthode échographique permettant d’évaluer la sévérité d’une hernie diaphragmatique congénitale ?
A) Mesure du rapport tête/circonférence abdominale (HC/AC)
B) Calcul du Lung-to-Head Ratio (LHR)
C) Doppler de l’artère pulmonaire
D) IRM fœtale pour évaluer le volume pulmonaire
E) Mesure de la longueur du diaphragme
✅ Réponse(s) correcte(s) :
B) Calcul du Lung-to-Head Ratio (LHR)
D) IRM fœtale pour évaluer le volume pulmonaire
Explication : Le LHR est un paramètre clé en échographie pour évaluer la sévérité de l’HDC. L’IRM fœtale permet une estimation plus précise du volume pulmonaire résiduel.
22 : Quels sont les facteurs échographiques associés à un mauvais pronostic dans l’HDC ?
A) LHR < 1.0
B) Herniation hépatique dans le thorax
C) Présence d’un hydrops fœtal
D) Position du foie sous-diaphragmatique
E) Ascite modérée isolée
✅ Réponse(s) correcte(s) :
A) LHR < 1.0
B) Herniation hépatique dans le thorax
C) Présence d’un hydrops fœtal
Explication : Un LHR < 1.0 indique une hypoplasie pulmonaire sévère, tandis que la herniation hépatique et la présence d’un hydrops sont des facteurs péjoratifs. Une position hépatique normale et une ascite isolée ne sont pas des marqueurs de gravité.
23 : Quelle est la prise en charge prénatale possible d’une HDC sévère ?
A) Surveillance échographique rapprochée
B) Pose d’un shunt pleuro-amniotique
C) Occlusion trachéale fœtoscopique (FETO)
D) Césarienne obligatoire à la naissance
E) Corticothérapie prénatale pour la maturation pulmonaire
✅ Réponse(s) correcte(s) :
A) Surveillance échographique rapprochée
C) Occlusion trachéale fœtoscopique (FETO)
Explication : La surveillance échographique est essentielle. La technique FETO, qui consiste à obstruer temporairement la trachée pour stimuler la croissance pulmonaire, peut être proposée dans les cas sévères. La césarienne n’est pas systématique, et la corticothérapie n’a pas d’indication spécifique dans l’HDC.
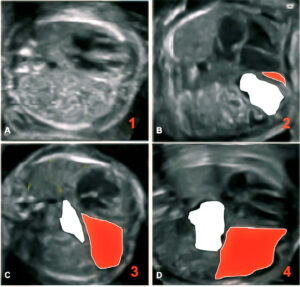
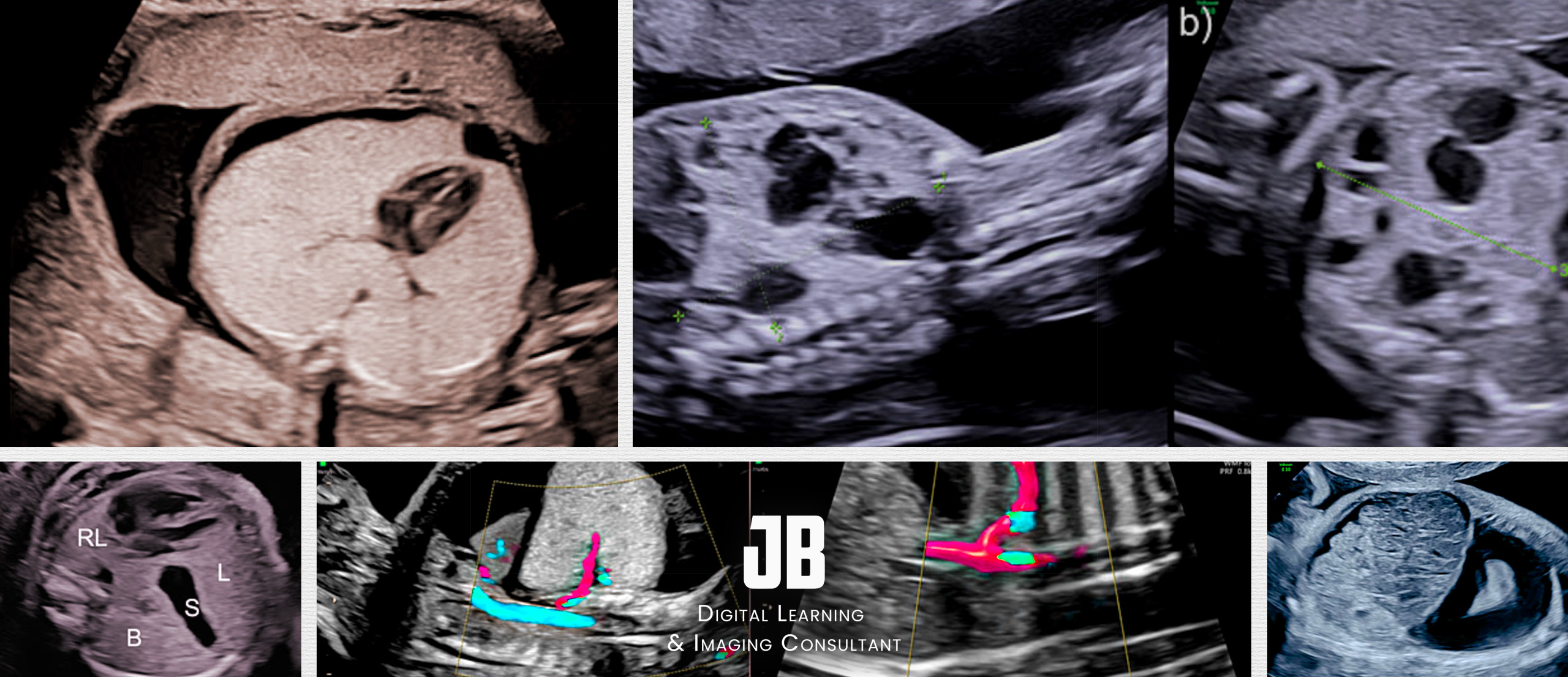
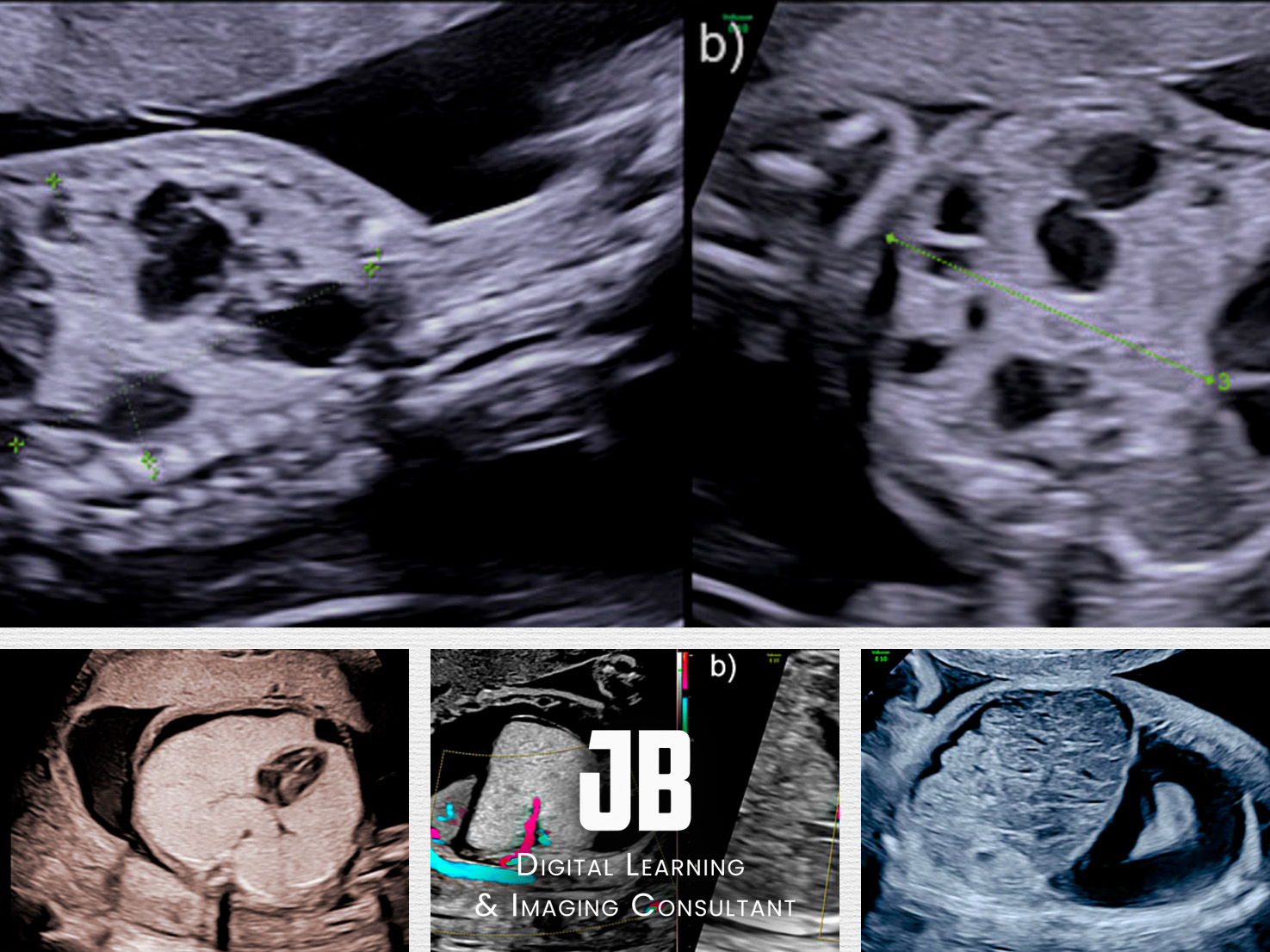
24 : Que représente cette série d’images en coupes axiales fœtales ?
A) Une séquence d’imagerie de l’abdomen fœtal
B) Une évolution progressive d’une hernie diaphragmatique congénitale (HDC)
C) Une classification des degrés de sévérité de l’HDC
D) Une comparaison entre une IRM fœtale et une échographie standard
E) Une analyse Doppler des flux sanguins pulmonaires
✅ Réponse(s) correcte(s) :
B) Une évolution progressive d’une hernie diaphragmatique congénitale (HDC)
C) Une classification des degrés de sévérité de l’HDC
Explication : Cette figure illustre différents stades ou degrés d’engagement des organes abdominaux dans le thorax fœtal, caractéristiques d’une HDC.
25 : Quelles structures sont mises en évidence par les couleurs sur ces images ?
A) Le foie en position intra-thoracique
B) Les poumons fœtaux
C) L’intestin hernié
D) Le diaphragme en position normale
E) Le liquide amniotique
✅ Réponse(s) correcte(s) :
A) Le foie en position intra-thoracique
C) L’intestin hernié
Explication : La coloration met en évidence les organes abdominaux déplacés dans le thorax, notamment le foie (en rouge) et l’intestin (en blanc), qui sont des marqueurs de sévérité de l’HDC.
26 : Quels critères permettent d’évaluer la sévérité de l’HDC ?
A) Le volume pulmonaire résiduel
B) La position du foie (intra-thoracique ou non)
C) Le Lung-to-Head Ratio (LHR)
D) L’épaisseur du diaphragme
E) La présence d’un hydramnios
✅ Réponse(s) correcte(s) :
A) Le volume pulmonaire résiduel
B) La position du foie (intra-thoracique ou non)
C) Le Lung-to-Head Ratio (LHR)
Explication : La sévérité de l’HDC est déterminée par le volume pulmonaire restant, la herniation hépatique et le LHR, qui prédit le risque d’hypoplasie pulmonaire.
27 : Quelle est la valeur pronostique d’une herniation hépatique dans l’HDC ?
A) Elle est associée à une hypoplasie pulmonaire plus sévère
B) Elle n’a pas d’impact sur le pronostic
C) Elle est associée à un meilleur taux de survie néonatale
D) Elle constitue une indication possible pour une occlusion trachéale fœtoscopique (FETO)
E) Elle entraîne une insuffisance hépatique fœtale
✅ Réponse(s) correcte(s) :
A) Elle est associée à une hypoplasie pulmonaire plus sévère
D) Elle constitue une indication possible pour une occlusion trachéale fœtoscopique (FETO)
Explication : La herniation hépatique est un facteur de mauvais pronostic, car elle réduit le volume pulmonaire fonctionnel. Dans certains cas, une intervention FETO peut être envisagée pour améliorer le développement pulmonaire in utero.
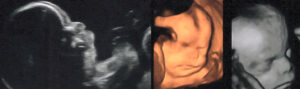
28 : Quelle est (sont) l’(les)anomalie(s) principale(s) visible(s) sur ces images échographiques ?
A) Profil facial normal
B) Hypertélorisme
C) Proéminence frontale
D) Hypoplasie de la mandibule
E) Macroglossie
✅ Réponse(s) correcte(s) :
B) Hypertélorisme
C) Proéminence frontale
D) Hypoplasie de la mandibule
Explication : Le syndrome de Pallister-Killian est caractérisé par des dysmorphies cranio-faciales, visibles ici en échographie 2D et 3D. On observe un hypertélorisme, une proéminence du front et une hypoplasie mandibulaire.
29 : Quels signes échographiques peuvent être associés au syndrome de Pallister-Killian ?
A) Polydactylie
B) Hydrops fœtal
C) Anomalies cérébrales (ventriculomégalie)
D) Anomalies diaphragmatique
E) Fentes palatines
✅ Réponse(s) correcte(s) :
B) Hydrops fœtal
C) Anomalies cérébrales (ventriculomégalie)
D) Anomalies diaphragmatique
E) Fentes palatines
Explication : Le syndrome de Pallister-Killian peut être associé à un hydrops fœtal, des malformations cérébrales, des hernies diaphragmatiques et des anomalies faciales comme les fentes palatines. La polydactylie n’est pas typique de ce syndrome.
30 : Quelle est la cause génétique du syndrome de Pallister-Killian ?
A) Trisomie 21 libre
B) Microdélétion 22q11
C) Tetrasomie en mosaïque du chromosome 12p
D) Duplication du chromosome X
E) Mutation du gène FGFR2
✅ Réponse(s) correcte(s) :
C) Tetrasomie en mosaïque du chromosome 12p
Explication : Le syndrome de Pallister-Killian est causé par une tetrasomie en mosaïque du chromosome 12p, détectable par FISH ou CGH-array, mais souvent absente en caryotype standard sur lymphocytes.
31 : Quel est l’apport de l’échographie 3D dans l’évaluation du syndrome de Pallister-Killian ?
- A) Permet une meilleure visualisation des anomalies faciales
B) Remplace totalement l’IRM cérébrale
C) Détecte les anomalies génétiques
D) Améliore le conseil prénatal pour les parents
E) Permet une meilleure évaluation du volume pulmonaire
✅ Réponse(s) correcte(s) :
- A) Permet une meilleure visualisation des anomalies faciales
- D) Améliore le conseil prénatal pour les parents
Explication : L’échographie 3D est particulièrement utile pour visualiser les dysmorphies faciales, facilitant ainsi le diagnostic prénatal et le conseil génétique. Elle ne remplace pas l’IRM, qui est essentielle pour l’évaluation cérébrale.
32 : Quels signes échographiques permettent de suspecter une HDC ?
- A) Déplacement du cœur vers le côté opposé
B) Visualisation de l’estomac en position intra-thoracique
C) Hypoplasie pulmonaire du côté atteint
D) Épanchement pleural bilatéral isolé
E) Présence d’une ascite modérée
✅ Réponse(s) correcte(s) :
- A) Déplacement du cœur vers le côté opposé
- B) Visualisation de l’estomac en position intra-thoracique
- C) Hypoplasie pulmonaire du côté atteint
Explication : L’HDC entraîne un déplacement du cœur, une herniation de l’estomac et/ou d’anses intestinales dans le thorax, et une hypoplasie pulmonaire. L’épanchement pleural et l’ascite ne sont pas spécifiques.
33 : Quelle est la méthode utilisée pour évaluer la sévérité d’une HDC ?
- A) Calcul du Lung-to-Head Ratio (LHR)
B) Doppler des artères pulmonaires
C) Mesure du diamètre abdominal
D) IRM pour estimer le volume pulmonaire
E) Caryotype fœtal systématique
✅ Réponse(s) correcte(s) :
- A) Calcul du Lung-to-Head Ratio (LHR)
- D) IRM pour estimer le volume pulmonaire
Explication : Le LHR permet d’évaluer la capacité pulmonaire résiduelle. L’IRM fœtale permet une analyse plus précise du volume pulmonaire total. Le Doppler des artères pulmonaires peut être complémentaire, mais n’est pas un critère principal.
QCM 34 : Quels sont les facteurs échographiques de mauvais pronostic en cas d’HDC ?
- A) LHR < 1.0
B) Herniation hépatique intra-thoracique
C) Hydrops fœtal
D) Position du foie sous-diaphragmatique
E) Absence de déplacement médiastinal
✅ Réponse(s) correcte(s) :
- A) LHR < 1.0
- B) Herniation hépatique intra-thoracique
- C) Hydrops fœtal
Explication : Une herniation hépatique, un LHR bas, et un hydrops sont des marqueurs de mauvais pronostic car ils indiquent une hypoplasie pulmonaire sévère et un risque de détresse respiratoire néonatale.
QCM 35 : Quelle est la prise en charge prénatale recommandée pour une HDC sévère ?
- A) Surveillance échographique rapprochée
B) Occlusion trachéale fœtoscopique (FETO)
C) Césarienne obligatoire à la naissance
D) Corticothérapie pour maturation pulmonaire
E) Interruption médicale de grossesse systématique
✅ Réponse(s) correcte(s) :
- A) Surveillance échographique rapprochée
- B) Occlusion trachéale fœtoscopique (FETO)
Explication : La surveillance échographique est essentielle. Pour les formes sévères (LHR < 1.0, hernie hépatique), une intervention FETO peut être indiquée pour améliorer la croissance pulmonaire. La césarienne n’est pas systématique, et la corticothérapie n’a pas de preuve d’efficacité spécifique pour l’HDC.
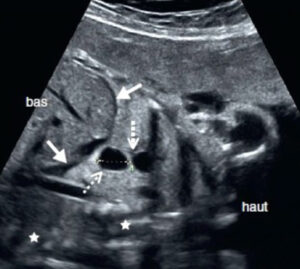
36 : Quel(s) élément(s) de cette image évoque(nt) un hydrothorax bilatéral ?
Épanchement pleural anéchogène autour des poumons
B. Déplacement du cœur en position centrale
C. Présence d’une masse solide intrathoracique
D. Visualisation de cloisons épaisses dans l’épanchement
E. Hyperéchogénicité diffuse du parenchyme pulmonaire
✅ Réponses exactes : A et B
➡ Explication : L’hydrothorax se manifeste par un épanchement pleural anéchogène, ce qui est visible sur l’image. Si l’épanchement est important, il peut provoquer un déplacement du cœur vers le centre ou le côté opposé.
37 : Quelle(s) pathologie(s) peut/peuvent être associée(s) à un hydrothorax fœtal ?
Chylothorax congénital
B. Hydrops fœtal
C. Séquence d’obstruction bronchique
D. Hernie diaphragmatique
E. Dysplasie bronchopulmonaire
✅ Réponses exactes : A, B et D
➡ Explication :
- Le chylothorax congénital est une cause fréquente d’hydrothorax, lié à une fuite de lymphe dans la cavité pleurale.
- L’hydrops fœtal, secondaire à une insuffisance cardiaque ou une anémie sévère, entraîne un épanchement pleural par augmentation de la pression hydrostatique.
- Une hernie diaphragmatique peut être associée à un épanchement pleural en raison d’une compression pulmonaire.
- La séquence d’obstruction bronchique est plutôt responsable d’une hyperinflation pulmonaire, et la dysplasie bronchopulmonaire est une complication postnatale, non une cause d’hydrothorax prénatal.
38 : Quel(s) impact(s) peut avoir un hydrothorax bilatéral sur le développement fœtal ?
Hypoplasie pulmonaire
B. Compression cardiaque avec insuffisance cardiaque
C. Ascite et anasarque fœtale
D. Oligoamnios sévère
E. Compression de l’œsophage entraînant une polyhydramnios
✅ Réponses exactes : A, B, C et E
➡ Explication :
- L’hypoplasie pulmonaire est une complication fréquente due à la compression des poumons par l’épanchement pleural.
- Une compression cardiaque peut entraîner une insuffisance cardiaque fœtale, favorisant un hydrops.
- L’anasarque fœtale peut être la conséquence d’une insuffisance cardiaque droite secondaire.
- Un polyhydramnios peut apparaître en cas de compression de l’œsophage par un médiastin refoulé, limitant la déglutition fœtale.
- En revanche, un oligoamnios est plus fréquemment associé à une pathologie rénale ou à une rupture prématurée des membranes.
39 : Quel(s) traitement(s) peut/peuvent être envisagé(s) en cas d’hydrothorax bilatéral symptomatique ?
Ponction pleurale fœtale sous contrôle échographique
B. Pose d’un shunt pleuro-amniotique
C. Administration intra-utérine d’antibiotiques
D. Corticothérapie maternelle
E. Fœtoscopie interventionnelle pour drainage bronchique
✅ Réponses exactes : A, B et D
➡ Explication :
- Une ponction pleurale est indiquée en cas d’épanchement volumineux menaçant la fonction cardiorespiratoire.
- Un shunt pleuro-amniotique permet un drainage continu et est recommandé dans les formes sévères.
- Une corticothérapie maternelle est indiquée si un accouchement prématuré est prévu, pour favoriser la maturation pulmonaire.
- L’administration intra-utérine d’antibiotiques n’est pas justifiée car l’hydrothorax n’est pas d’origine infectieuse.
- Une fœtoscopie interventionnelle est utilisée pour certaines pathologies obstructives mais pas pour l’hydrothorax.
40 : Quel(s) élément(s) de cette image évoque(nt) un hydrothorax unilatéral ?
Présence d’un épanchement pleural anéchogène
B. Déviation du cœur vers le côté opposé
C. Cloisons épaisses visibles dans le liquide pleural
D. Hyperéchogénicité pulmonaire homogène
E. Présence d’un arc vasculaire anormal
✅ Réponses exactes : A et B
➡ Explication : L’hydrothorax unilatéral est caractérisé par un épanchement pleural anéchogène, visible sur cette coupe axiale. Si l’épanchement est important, il peut provoquer une déviation du cœur vers le côté opposé. La présence de cloisons épaisses est atypique et peut suggérer une infection ou un épanchement organisé. Une hyperéchogénicité homogène du parenchyme pulmonaire n’est pas un signe caractéristique de l’hydrothorax. L’identification d’un arc vasculaire anormal pourrait évoquer une séquestration pulmonaire, ce qui n’est pas le cas ici.
41 : Parmi les diagnostics différentiels de l’hydrothorax fœtal unilatéral, lequel (lesquels) peut (peuvent) être envisagé(s) ?
Séquestration pulmonaire
B. Hernie diaphragmatique congénitale
C. Malformation adénomatoïde kystique congénitale (CCAM)
D. Atrésie bronchique
E. Fibrose kystique
✅ Réponses exactes : A, B, C et D
➡ Explication :
- La séquestration pulmonaire peut se présenter sous forme d’une masse hyperechogène associée à un épanchement pleural.
- La hernie diaphragmatique peut entraîner une accumulation de liquide dans le thorax en raison d’une compression pulmonaire.
- Une malformation adénomatoïde kystique congénitale (CCAM) peut être associée à un épanchement pleural dans certaines formes macro-kystiques.
- Une atrésie bronchique entraîne une distension pulmonaire qui peut s’accompagner d’un épanchement pleural secondaire.
- La fibrose kystique n’est pas un diagnostic différentiel prénatal de l’hydrothorax.
42 : Quelle(s) évolution(s) possible(s) peut/peuvent être observée(s) en cas d’hydrothorax unilatéral ?
Résorption spontanée
B. Progression vers un hydrothorax bilatéral
C. Développement d’un hydrops fœtal
D. Apparition d’une ascite secondaire
E. Obstruction complète des bronches
✅ Réponses exactes : A, B, C et D
➡ Explication :
- L’hydrothorax fœtal peut se résorber spontanément dans certains cas bénins.
- Il peut également progresser vers un hydrothorax bilatéral, notamment en cas de dysfonction lymphatique persistante.
- Dans les formes sévères, il peut évoluer vers un hydrops fœtal par insuffisance cardiaque droite.
- Une ascite secondaire peut apparaître en raison d’une hypoalbuminémie ou d’une hypertension veineuse.
- Une obstruction bronchique complète n’est pas une conséquence directe d’un hydrothorax.
43 : Dans quelle(s) situation(s) un shunt pleuro-amniotique est-il indiqué pour traiter un hydrothorax unilatéral ?
Épanchement pleural massif entraînant une hypoplasie pulmonaire
B. Hydrops fœtal secondaire à l’épanchement pleural
C. Épanchement unilatéral modéré et stable
D. Présence de cloisons multiples dans l’épanchement
E. Épanchement pleural associé à une hernie diaphragmatique
✅ Réponses exactes : A et B
➡ Explication :
- Un shunt pleuro-amniotique est indiqué en cas d’épanchement pleural massif qui compromet la fonction pulmonaire et cardiaque.
- Il est également indiqué en présence d’un hydrops fœtal secondaire pour tenter d’améliorer l’hémodynamique fœtale.
- Un épanchement modéré et stable ne justifie pas d’intervention invasive.
- La présence de cloisons multiples suggère une infection ou un processus tumoral, et peut limiter l’efficacité du shunt.
- Un épanchement associé à une hernie diaphragmatique nécessite une prise en charge spécifique avant de poser un shunt.
44 : Quel(s) élément(s) doit/doivent être surveillé(s) chez un nouveau-né ayant eu un hydrothorax fœtal ?
Fonction respiratoire et signes d’hypoplasie pulmonaire
B. Persistance d’un épanchement pleural à la naissance
C. Évaluation de la fonction cardiaque
D. Risque de complications infectieuses pulmonaires
E. Évaluation du développement neurologique
✅ Réponses exactes : A, B, C et D
➡ Explication :
- La fonction respiratoire doit être évaluée car une hypoplasie pulmonaire peut entraîner une détresse respiratoire néonatale.
- Une persistance de l’épanchement pleural nécessite une surveillance et parfois un drainage postnatal.
- Une évaluation cardiaque est importante, notamment si l’épanchement était associé à une compression médiastinale.
- Un risque infectieux pulmonaire existe en cas de drainage pleural ou de pneumopathie associée.
- Le développement neurologique n’est pas directement lié à l’hydrothorax, sauf en cas d’hypoxie sévère prolongée.
45 : Diagnostic échographique de l’anomalie observée. Que met en évidence cette image échographique ?
A. Une masse pulmonaire hyperéchogène
B. Une structure kystique macrokystique
C. Une déviation du diaphragme
D. Un épanchement pleural
E. Une vascularisation systémique anormale
✅ Réponses exactes : A, B et C
➡ Explication :
- Cette image illustre une maladie adénomatoïde kystique pulmonaire (MAKP) droite macrokystique, caractérisée par la présence de kystes anéchogènes au sein d’une masse pulmonaire hyperéchogène.
- Une déviation du diaphragme est observée, due à l’effet de masse de la lésion.
- Un épanchement pleural peut être associé, mais il n’est pas visible ici.
46 : Quelle(s) complication(s) peut/peuvent survenir en cas de MAKP volumineuse ?
A. Hypoplasie pulmonaire
B. Hydrops fœtal
C. Insuffisance cardiaque fœtale
D. Régression spontanée au troisième trimestre
E. Compression de la trachée entraînant une obstruction complète des voies aériennes
✅ Réponses exactes : A, B, C et D
➡ Explication :
- Une hypoplasie pulmonaire est fréquente lorsque la masse pulmonaire compresse le poumon controlatéral.
- Un hydrops fœtal peut survenir si l’effet de masse entraîne une obstruction du retour veineux cave ou une compression cardiaque.
- Une insuffisance cardiaque fœtale peut apparaître dans les cas sévères, nécessitant une intervention prénatale.
- Dans certains cas, une régression spontanée est observée au troisième trimestre, avec une diminution relative de la taille de la masse.
- Une compression trachéale sévère est rare avec la MAKP, contrairement à certaines atrésies laryngées.
47 : Quelle(s) approche(s) thérapeutique(s) peut/peuvent être envisagée(s) dans la prise en charge d’une MAKP volumineuse avec retentissement fœtal ?
A. Surveillance échographique rapprochée
B. Ponction ou drainage in utero des kystes volumineux
C. Administration maternelle de corticoïdes en cas de risque d’accouchement prématuré
D. Exérèse chirurgicale postnatale en cas de persistance symptomatique
E. Embolisation des vaisseaux irriguant la masse
✅ Réponses exactes : A, B, C et D
➡ Explication :
- Une surveillance échographique rapprochée est nécessaire pour suivre l’évolution de la lésion et détecter d’éventuelles complications.
- Un drainage in utero peut être envisagé pour les formes macrokystiques compressives afin de soulager la compression médiastinale.
- Une corticothérapie maternelle est recommandée si un accouchement prématuré est probable, afin d’améliorer la maturation pulmonaire.
- Une exérèse chirurgicale postnatale est indiquée en cas de persistance de la lésion et de gêne respiratoire néonatale.
- L’embolisation des vaisseaux n’a pas d’indication ici, car la MAKP n’a pas de vascularisation systémique aberrante contrairement à une séquestration pulmonaire.
48 : Que montre cette image échographique ?
Une malformation adénomatoïde kystique pulmonaire (MAKP) microkystique
B. Un épanchement pleural anéchogène
C. Une séquestration pulmonaire
D. Un hydrops fœtal
E. Une hernie diaphragmatique
✅ Réponses exactes : A et D
➡ Explication :
- Cette image illustre une maladie adénomatoïde kystique pulmonaire (MAKP) microkystique, caractérisée par une structure pulmonaire hyperéchogène, sans kystes macrokystiques visibles.
- Un hydrops fœtal est présent, comme le suggère l’œdème sous-cutané visible (flèche noire)
- Il n’y a pas d’épanchement pleural anéchogène ici, mais la MAKP peut parfois s’accompagner d’un hydrothorax.
- Une séquestration pulmonaire présente généralement une vascularisation systémique anormale, absente ici.
- Il ne s’agit pas d’une hernie diaphragmatique, car on ne voit pas de structures abdominales dans le thorax.
49 : Quelle(s) complication(s) peut/peuvent survenir en cas de MAKP microkystique volumineuse ?
Hypoplasie pulmonaire
B. Hydrops fœtal
C. Compression cardiaque avec déviation médiastinale
D. Régression spontanée au troisième trimestre
E. Obstruction trachéale complète
✅ Réponses exactes : A, B, C et D
➡ Explication :
- Une hypoplasie pulmonaire peut survenir si la masse empêche le développement normal du poumon controlatéral.
- Un hydrops fœtal peut apparaître lorsque la compression thoracique entraîne une insuffisance cardiaque et un œdème généralisé.
- Une déviation médiastinale est visible sur l’image, provoquée par l’effet de masse de la MAKP sur le cœur.
- Dans certains cas, une régression spontanée de la MAKP est observée en fin de grossesse.
- Une obstruction trachéale complète n’est pas une conséquence habituelle de la MAKP microkystique.
50 : Dans quel(s) cas un drainage in utero peut-il être indiqué pour cette pathologie ?
Présence d’un kyste unique de plus de 2 cm
B. Apparition d’un hydrops fœtal
C. Déplacement majeur du cœur avec compression cardiaque
D. Oligoamnios sévère
E. Suspection d’une infection intra-utérine associée
✅ Réponses exactes : B et C
➡ Explication :
- Un hydrops fœtal justifie souvent une intervention fœtale pour diminuer la pression thoracique.
- Une compression cardiaque majeure peut nécessiter un drainage in utero pour éviter une insuffisance cardiaque fœtale.
- Un kyste unique de plus de 2 cm peut être drainé dans les formes macrokystiques, mais la MAKP ici est microkystique, donc ce critère ne s’applique pas.
- Un oligoamnios sévère n’est pas une indication spécifique de drainage pulmonaire.
- Une infection intra-utérine relève d’une autre prise en charge.
51 : Quelle(s) prise(s) en charge est(sont) recommandée(s) après la naissance pour un nouveau-né ayant eu une MAKP microkystique avec hydrops ?
Intubation et assistance ventilatoire en cas de détresse respiratoire
B. Résection chirurgicale de la lésion si symptomatique
C. Surveillance échographique pulmonaire durant les premiers mois
D. Traitement par antibiotiques systématiques
E. Drainage postnatal immédiat du poumon atteint
✅ Réponses exactes : A, B et C
➡ Explication :
- Un nouveau-né avec MAKP volumineuse peut présenter une détresse respiratoire nécessitant une intubation.
- Une résection chirurgicale est indiquée si la lésion persiste et entraîne des symptômes respiratoires.
- Une surveillance échographique permet d’évaluer l’évolution de la lésion après la naissance.
- Une antibiothérapie systématique n’est pas indiquée en l’absence d’infection.
- Un drainage pulmonaire postnatal immédiat n’est pas systématique pour une MAKP microkystique, sauf en cas de complications.
52 : Que montre cette image échographique ?
Une séquestration pulmonaire
B. Une malformation adénomatoïde kystique pulmonaire (MAKP)
C. Une hernie diaphragmatique
D. Une duplication œsophagienne
E. Un hydrothorax
✅ Réponses exactes : A
➡ Explication :
- Cette image met en évidence une séquestration pulmonaire, caractérisée par une masse hyperéchogène bien limitée.
- La vascularisation systémique de la masse est démontrée en Doppler couleur, avec une artère nourricière issue de l’aorte (flèches noires), ce qui confirme le diagnostic.
- Contrairement à la MAKP, la séquestration pulmonaire ne communique pas avec les bronches et a une vascularisation systémique et non pulmonaire.
- Il n’y a pas de contenu digestif intra-thoracique permettant d’évoquer une hernie diaphragmatique.
- Une duplication œsophagienne se présente généralement comme une structure kystique postérieure, ce qui n’est pas le cas ici.
- Aucun épanchement pleural n’est visible sur cette image.
53 : Caractéristiques échographiques de la séquestration pulmonaire Quelles sont les caractéristiques échographiques typiques d’une séquestration pulmonaire ?
Masse hyperéchogène bien délimitée
B. Présence d’une vascularisation systémique en Doppler couleur
C. Communication avec les bronches
D. Situation possible intra- ou extralobaire
E. Évolution fréquente vers une régression spontanée
✅ Réponses exactes : A, B et D
➡ Explication :
- La séquestration pulmonaire se manifeste par une masse hyperéchogène bien définie.
- Une vascularisation systémique est toujours présente, ce qui est confirmé ici par le Doppler couleur montrant une artère issue de l’aorte.
- Contrairement à la MAKP, la séquestration ne communique pas avec les bronches (C est donc faux).
- Elle peut être intralobaire ou extralobaire, cette dernière forme étant plus souvent associée à des malformations congénitales.
- La régression spontanée est rare, contrairement à certaines MAKP qui peuvent diminuer en taille durant la grossesse.
54 : Quelle(s) complication(s) peut/peuvent survenir en cas de séquestration pulmonaire fœtale ?
Hydrops fœtal
B. Compression médiastinale avec déviation cardiaque
C. Infections pulmonaires postnatales
D. Transformation maligne en postnatal
E. Obstruction bronchique
✅ Réponses exactes : A, B et C
➡ Explication :
- Une séquestration pulmonaire volumineuse peut entraîner un hydrops fœtal en raison de la compression des structures vasculaires thoraciques.
- Une compression médiastinale avec déplacement du cœur peut survenir.
- En postnatal, une séquestration pulmonaire peut s’infecter, nécessitant alors une prise en charge chirurgicale.
- Il n’y a pas de risque de transformation maligne.
- La séquestration ne communique pas avec les bronches, donc elle n’entraîne pas d’obstruction bronchique.
55 : Quelle(s) approche(s) thérapeutique(s) peut/peuvent être envisagée(s) en cas de séquestration pulmonaire prénatale ?
Surveillance échographique régulière
B. Embolisation prénatale des vaisseaux nourriciers
C. Drainage fœtal en cas de compression sévère
D. Résection chirurgicale postnatale si symptomatique
E. Traitement antibiotique systématique en postnatal
✅ Réponses exactes : A, C et D
➡ Explication :
- Une surveillance échographique est essentielle pour suivre l’évolution de la lésion et détecter d’éventuelles complications.
- Une embolisation prénatale n’est pas une approche courante in utero.
- Un drainage fœtal peut être envisagé en cas d’hydrops menaçant la survie fœtale.
- Une résection chirurgicale postnatale est indiquée si la séquestration est symptomatique ou s’infecte.
- Un traitement antibiotique systématique n’est pas nécessaire en l’absence d’infection.
Quiz
QUESTIONS À RÉPONSES COURTES
✅ Réponse :
La coupe axiale est fondamentale pour l’analyse du thorax fœtal. Elle permet d’identifier les deux poumons, qui doivent être symétriques et homogènes, ainsi que le cœur, dont l’apex doit normalement être dirigé vers la gauche. Le diaphragme est visible comme une ligne hyperéchogène séparant le thorax de l’abdomen. La trachée peut être identifiée sous forme d’une structure anéchogène médiane. En cas de hernie diaphragmatique congénitale, on peut observer un déplacement du cœur et la présence d’organes abdominaux dans le thorax, ce qui aide à poser le diagnostic.
✅ Réponse :
L’échogénicité pulmonaire varie au cours du développement fœtal. Au premier trimestre, les poumons sont hypoéchogènes, proches de l’échogénicité du liquide amniotique. Au deuxième trimestre, leur échogénicité augmente progressivement en raison de la croissance des bronchioles terminales et du développement du tissu conjonctif. Au troisième trimestre, les poumons deviennent plus hyperéchogènes par rapport au foie, traduisant une meilleure différenciation alvéolaire. Une échogénicité anormalement élevée ou asymétrique peut suggérer une anomalie pulmonaire, comme une maladie adénomatoïde kystique pulmonaire (MAKP).
✅ Réponse :
Plusieurs signes échographiques permettent de diagnostiquer une hernie diaphragmatique congénitale (HDC). Le plus évocateur est le déplacement du cœur vers le côté opposé à la hernie. On peut également observer la présence d’organes abdominaux dans le thorax, notamment l’estomac (HDC gauche) ou le foie (HDC droite). L’absence de continuité du diaphragme est un autre signe clé. De plus, un hydramnios peut être présent en raison de la compression de l’œsophage empêchant la déglutition du liquide amniotique.
✅ Réponse :
Le LHR (Lung-to-Head Ratio) est un paramètre échographique utilisé pour estimer la sévérité de l’hypoplasie pulmonaire, notamment en cas de hernie diaphragmatique. Il se calcule en divisant la surface pulmonaire controlatérale (le poumon non affecté par la hernie) par le périmètre céphalique. Un LHR > 45% est associé à un bon pronostic, tandis qu’un LHR < 25% indique un risque élevé d’hypoplasie pulmonaire sévère et de complications postnatales. Ce paramètre est essentiel pour orienter la prise en charge et décider d’une éventuelle intervention prénatale comme l’occlusion trachéale fœtoscopique (FETO).
✅ Réponse :
La séquestration pulmonaire se manifeste en échographie comme une masse pulmonaire hyperéchogène, généralement située dans le lobe inférieur du poumon gauche. Pour confirmer le diagnostic, le Doppler couleur est utilisé afin de détecter la présence d’un vaisseau artériel systémique anormal issu de l’aorte thoracique ou abdominale. Contrairement à une maladie adénomatoïde kystique pulmonaire (MAKP), la séquestration pulmonaire ne contient pas de kystes visibles.
✅ Réponse :
Le chylothorax fœtal se caractérise par un épanchement pleural anéchogène, souvent bilatéral. Il peut provoquer une compression pulmonaire, entraînant une hypoplasie pulmonaire si l’épanchement est massif et persistant. Dans certains cas, il est associé à un hydrops fœtal, marqué par la présence d’un épanchement péricardique, d’une ascite et d’un œdème cutané.
✅ Réponse :
L’échographie permet de quantifier l’épanchement pleural, d’évaluer son impact sur la fonction pulmonaire et cardiaque, et de guider d’éventuelles interventions prénatales. En cas d’épanchement volumineux, une ponction pleurale fœtale (thoracocentèse) peut être réalisée sous guidage échographique. Si l’épanchement récidive, la pose d’un shunt pleuro-amniotique peut être envisagée pour améliorer le pronostic respiratoire néonatal.
✅ Réponse :
La MAKP se présente sous forme d’une masse hyperéchogène contenant des kystes de tailles variables, alors que la séquestration pulmonaire est une masse homogène sans kystes. Le Doppler est indispensable : la séquestration pulmonaire possède une vascularisation systémique anormale, tandis que la MAKP est vascularisée par la circulation pulmonaire normale.
✅ Réponse :
Le mode M permet d’étudier le mouvement du diaphragme, essentiel pour diagnostiquer une paralysie diaphragmatique. Une paralysie diaphragmatique se manifeste par un mouvement paradoxal du diaphragme : il se soulève lors de l’inspiration au lieu de s’abaisser. Cette anomalie peut être associée à une compression nerveuse ou une anomalie congénitale du diaphragme.
✅ Réponse :
Une masse médiastinale peut apparaître en échographie comme une structure hyperéchogène, mixte ou anéchogène, selon sa nature (tératome, kyste bronchogénique, séquestration médiastinale). Elle peut provoquer une déviation du cœur et des gros vaisseaux, un hydramnios (par compression de l’œsophage) et une hypoplasie pulmonaire en cas de compression pulmonaire importante. Le Doppler couleur permet de préciser la vascularisation, aidant à différencier une séquestration médiastinale d’une autre masse.
✅ Réponse :
Une hernie diaphragmatique gauche (HDCG) est plus fréquente et se manifeste par la présence de l’estomac et/ou des anses intestinales dans l’hémithorax gauche, souvent associée à une déviation du cœur vers la droite. Une hernie diaphragmatique droite (HDCD) est plus difficile à diagnostiquer car le foie peut masquer l’anomalie. Elle est suspectée en cas de déviation cardiaque vers la gauche et de visualisation d’une structure hépatique en position thoracique, avec un alignement anormal de la veine ombilicale et du canal d’Arantius.
✅ Réponse :
L’échographie permet d’évaluer l’évolution de l’hydramnios, souvent secondaire à une compression de l’œsophage (comme dans une HDC ou une tumeur médiastinale). Elle aide à surveiller l’augmentation du volume pulmonaire, la déviation des structures médiastinales et les signes d’insuffisance cardiaque fœtale. Un hydramnios sévère peut nécessiter une amnioréduction ou une prise en charge spécifique de la cause sous-jacente.
✅ Réponse :
L’atrésie bronchique se manifeste en échographie par une masse pulmonaire hyperéchogène, secondaire à une rétention de liquide dans le parenchyme pulmonaire distendu. Cette anomalie est souvent unilatérale, sans kystes visibles. On observe fréquemment une déviation du médiastin, pouvant entraîner une compression pulmonaire controlatérale. Le Doppler couleur montre une vascularisation pulmonaire normale, ce qui aide à différencier cette anomalie d’une séquestration pulmonaire.
✅ Réponse :
L’échographie permet d’évaluer la gravité des anomalies thoraciques, ce qui influence la planification de l’accouchement et la prise en charge néonatale. En cas de lésions sévères avec compression pulmonaire et médiastinale, un accouchement en centre de niveau III est recommandé pour assurer une prise en charge néonatale spécialisée (ventilation, chirurgie). Certaines anomalies (HDC sévère, masses médiastinales volumineuses) peuvent justifier une césarienne programmée pour minimiser le stress néonatal et optimiser les soins postnataux immédiats.
ÉTUDES DE CAS FICTIFS

Contexte :
Une patiente de 28 ans, primigeste, est adressée pour une échographie morphologique de routine à 22 SA. L’échographie montre une lésion hyperechogène dans le champ pulmonaire gauche, sans déplacement médiastinal apparent.
Questions :
- Quel est le diagnostic différentiel principal ?
- Quels examens complémentaires recommandez-vous ?
- Quelle est la conduite à tenir pour le suivi prénatal ?
Réponses :
- Diagnostic différentiel :
- Maladie adénomatoïde kystique pulmonaire (MAKP)
- Séquestration pulmonaire
- Emphysème lobaire congénital
- Kyste bronchogénique
- Examens complémentaires :
- Doppler couleur pour rechercher une vascularisation systémique (en faveur d’une séquestration).
- Évaluation du Lung-to-Head Ratio (LHR) pour estimer le risque d’hypoplasie pulmonaire.
- IRM fœtale si la lésion est volumineuse pour préciser le volume pulmonaire restant.
- Conduite à tenir :
- Suivi échographique mensuel pour évaluer l’évolution de la masse.
- Pas d’intervention prénatale en l’absence de compression médiastinale ou d’hydrops.
- Consultation avec un centre de référence pour discuter de la nécessité d’une résection postnatale.
Contexte :
Une patiente de 32 ans, G3P1, est adressée à 26 SA pour un hydramnios sévère (AFI = 27 cm). L’échographie montre une masse kystique pulmonaire gauche avec déplacement du cœur à droite.
Questions :
- Quel est le diagnostic le plus probable ?
- Quels éléments échographiques permettent d’affiner le pronostic ?
- Quel est le suivi recommandé ?
Réponses :
- Diagnostic probable :
- Maladie adénomatoïde kystique pulmonaire macrokystique (MAKP type I).
- Éléments pronostiques :
- LHR : < 1 est un facteur de mauvais pronostic.
- Présence d’une ascite ou d’un hydramnios sévère, suggérant un risque de compression médiastinale.
- Déplacement du cœur : plus il est important, plus la sévérité de l’hypoplasie pulmonaire est élevée.
- Suivi recommandé :
- Surveillance échographique toutes les 2 semaines pour évaluer l’évolution.
- Consultation en centre de médecine fœtale pour discuter d’une éventuelle réduction kystique in utero (thoraco-amniodrainage).
- Planification d’une naissance en centre tertiaire avec réanimation néonatale et chirurgie pédiatrique.
Contexte :
Lors d’une échographie de dépistage à 24 SA, une image anéchogène est observée dans le thorax gauche avec disparition de l’estomac intra-abdominal.
Questions :
- Quel est le diagnostic le plus probable ?
- Quels sont les éléments échographiques déterminants ?
- Quelle est la prise en charge obstétricale recommandée ?
Réponses :
- Diagnostic probable :
- Hernie diaphragmatique congénitale gauche.
- Éléments échographiques clés :
- Position de l’estomac intrathoracique.
- Déviation cardiaque vers la droite.
- LHR et position du foie (intra-thoracique = mauvais pronostic).
- Prise en charge :
- Surveillance échographique toutes les 2 semaines pour évaluer la progression.
- Consultation en centre de référence pour envisager un FETO (occlusion trachéale fœtoscopique) si LHR bas.
- Accouchement en centre de niveau III avec équipe de chirurgie néonatale.
Contexte :
Une femme de 29 ans, G2P1, est adressée à 30 SA pour la découverte d’un épanchement pleural bilatéral modéré, sans signes d’hydrops.
Questions :
- Quel est le diagnostic différentiel ?
- Quels examens complémentaires recommandez-vous ?
- Quelle est la prise en charge prénatale ?
Réponses :
- Diagnostic différentiel :
- Chylothorax congénital.
- Infection intra-utérine (CMV, parvovirus).
- Malformation lymphatique thoracique.
- Examens complémentaires :
- PCR CMV et parvovirus sur liquide amniotique.
- Doppler des veines ombilicales pour rechercher une anasarque débutante.
- Prise en charge :
- Surveillance hebdomadaire.
- Ponction pleurale si compression pulmonaire.
- Discussion d’un shunt pleuro-amniotique si récidive.
Contexte :
Un fœtus de 26 SA présente une masse hyperéchogène intrathoracique droite sans signe de compression médiastinale ni d’hydrops.
Questions :
- Quel diagnostic évoquez-vous ?
- Comment différencier une séquestration pulmonaire d’une MAKP ?
- Quelle est la prise en charge postnatale ?
Réponses :
- Diagnostic probable :
- Séquestration pulmonaire.
- Différenciation par Doppler :
- Séquestration : vascularisation par une artère systémique.
- MAKP : absence de vascularisation systémique propre.
- Prise en charge postnatale :
- Surveillance et résection chirurgicale après naissance si lésions symptomatiques.
Contexte :
Une patiente de 30 ans, G2P1, est adressée à 24 SA pour la découverte d’une masse hyperéchogène pulmonaire droite, mesurant 25 mm, avec une vascularisation systémique détectée au Doppler.
Questions :
Quel est le diagnostic le plus probable ?
Comment différencier cette masse d’une autre malformation pulmonaire ?
Quelle est la prise en charge prénatale recommandée ?
Réponses :
Diagnostic probable :
Séquestration pulmonaire intralobaire, en raison de la vascularisation systémique anormale détectée en Doppler couleur.
Différenciation des autres anomalies pulmonaires :
MAKP : présence de kystes et absence de vascularisation systémique propre.
Emphysème lobaire congénital : hyperinflation pulmonaire mais sans vascularisation systémique anormale.
Prise en charge prénatale :
Suivi échographique mensuel pour surveiller la croissance de la masse et l’apparition d’un éventuel hydrops.
IRM fœtale pour quantifier le volume pulmonaire restant et préciser la structure de la masse.
Discussion en centre de référence pour planifier une éventuelle chirurgie postnatale.
Contexte :
Lors du suivi échographique d’une grossesse à 27 SA, un déplacement progressif du cœur vers la droite est observé. Une masse pulmonaire homogène, hyperéchogène, sans vascularisation anormale est détectée.
Questions :
Quel est le diagnostic le plus probable ?
Quels sont les éléments de gravité à rechercher ?
Quelle est la prise en charge obstétricale recommandée ?
Réponses :
Diagnostic probable :
Maladie adénomatoïde kystique pulmonaire (MAKP) de type III, en raison de l’aspect hyperéchogène homogène.
Éléments de gravité :
Hydrops fœtal (ascite, épanchement pleural, œdème cutané).
Compression du retour veineux systémique entraînant une insuffisance cardiaque fœtale.
Prise en charge obstétricale :
Surveillance échographique toutes les 2 semaines.
Si signes de compression sévère, discussion d’un shunt thoraco-amniotique.
Naissance programmée dans un centre de niveau III avec service de chirurgie néonatale.
Contexte :
Une femme enceinte de 29 ans, G1P0, est référée à 28 SA pour un épanchement pleural droit isolé, modéré, sans autres anomalies détectées.
Questions :
Quel est le diagnostic différentiel ?
Quels examens complémentaires recommandez-vous ?
Quelle est la conduite à tenir ?
Réponses :
Diagnostic différentiel :
Chylothorax congénital (cause la plus fréquente).
Infection congénitale (CMV, parvovirus B19).
Tumeur médiastinale (kyste bronchogénique).
Examens complémentaires :
PCR CMV et parvovirus B19 sur liquide amniotique.
Doppler veineux pour rechercher une anasarque débutante.
Conduite à tenir :
Surveillance échographique toutes les 2 semaines.
Ponction pleurale si augmentation rapide de l’épanchement.
Discussion d’un shunt pleuro-amniotique si récidive ou impact hémodynamique.
Contexte :
Un fœtus de 25 SA est diagnostiqué avec une hernie diaphragmatique gauche et un volume pulmonaire réduit. L’examen morphologique est normal.
Questions :
Quelle est la première étape après confirmation du diagnostic ?
Quels sont les principaux éléments pronostiques à évaluer ?
Quel suivi recommandez-vous ?
Réponses :
Première étape :
Amniocentèse pour rechercher une anomalie chromosomique (trisomie 18, syndrome de Pallister-Killian).
Éléments pronostiques :
LHR : un LHR < 1 est associé à un mauvais pronostic.
Présence du foie dans le thorax (aggrave l’hypoplasie pulmonaire).
Suivi recommandé :
Surveillance échographique toutes les 2 semaines.
IRM fœtale pour préciser le volume pulmonaire total.
Accouchement en centre de chirurgie néonatale, avec discussion d’un FETO (occlusion trachéale fœtoscopique) si nécessaire.
Contexte :
À 30 SA, une échographie morphologique montre une masse kystique anéchogène dans le médiastin, avec déviation trachéale et cardiaque.
Questions :
Quel est le diagnostic le plus probable ?
Quels examens permettent de préciser ce diagnostic ?
Quelle est la prise en charge prénatale et postnatale ?
Réponses :
Diagnostic probable :
Kyste bronchogénique médiastinal.
Examens complémentaires :
IRM fœtale pour préciser la localisation et les rapports avec la trachée.
Échographie Doppler pour exclure une séquestration pulmonaire associée.
Prise en charge prénatale et postnatale :
Surveillance échographique toutes les 3 semaines pour évaluer la compression.
Naissance en centre spécialisé avec évaluation néonatale immédiate.
Résection chirurgicale postnatale si symptômes respiratoires ou compression des voies aériennes.
PowerPoint Slides

- Présentation du cours
- Objectifs pédagogiques
- Plan du cours
- Importance de l’échographie thoracique fœtale
- Indications principales
- Défis et limites diagnostiques
- Diagnostic des malformations pulmonaires et diaphragmatiques
- Évaluation du développement pulmonaire
- Orientation des décisions obstétricales
- Alternative à l’IRM en cas de contre-indication
- Mode 2D (B-mode) : structure et morphologie
- Doppler couleur : circulation sanguine
- Mode M : mouvement du diaphragme
- Mode 3D/4D : visualisation volumique
- Poumons
- Diaphragme
- Cœur et médiastin
- Cage thoracique
- Coupe axiale : évaluation globale
- Coupe longitudinale parasagittale : analyse du diaphragme
- Coupe coronale : symétrie pulmonaire
- Phase pseudoglandulaire (5-17 SA)
- Phase canaliculaire (16-26 SA)
- Phase sacculaire (24-36 SA)
- Phase alvéolaire (après 36 SA)
- Volume pulmonaire
- Lung-to-Head Ratio (LHR)
- Présence d’épanchements
- LHR > 45% : bon pronostic
- LHR 25-45% : pronostic intermédiaire
- LHR < 25% : risque élevé d’hypoplasie pulmonaire
- Évaluation de la circulation pulmonaire
- Identification des anomalies vasculaires
- Différenciation des masses pulmonaires
- Déplacement du cœur
- Présence d’organes abdominaux dans le thorax
- Hypoplasie pulmonaire associée
- Présence de kystes pulmonaires
- Hypoplasie pulmonaire possible
- Risque de compression médiastinale
- Masse pulmonaire hyperéchogène
- Vascularisation systémique anormale (Doppler couleur)
- Absence de connexion bronchique
- Épanchement anéchogène
- Compression pulmonaire
- Hydrops fœtal possible
- Masse mixte avec composantes solides et kystiques
- Déviation médiastinale
- Présence possible de calcifications
- Fréquence des échographies
- Évaluation de la progression de l’anomalie
- Planification de l’accouchement
- Intubation immédiate si détresse respiratoire
- Chirurgie en fonction de l’évolution
- Surveillance en soins intensifs néonataux
- Importance du diagnostic échographique
- Impact sur la prise en charge obstétricale et néonatale
- Questions et échanges
Fiche-Synthèse
- Hernie Diaphragmatique Congénitale (HCD) :
- Diagnostic et évaluation: Importance cruciale de l’échographie pour le diagnostic et l’évaluation de la HCD.
- Facteurs pronostiques:LHR (Lung-to-Head Ratio): Technique de mesure, intérêt et limites. LHR observé/attendu (LHRo/a) : calcul et interprétation. Les difficultés de la mesure du LHR sont liées à la position fœtale.
- Position de l’estomac: Classification de Cordier et corrélation avec le pronostic. Grades de 1 à 4.
- IRM thoracique fœtale: Évaluation du volume pulmonaire et du volume hépatique.
- Autres: Hydramnios, déviation médiastinale, anomalies cardiaques associées.
- Prise en charge: Nécessité d’une prise en charge multidisciplinaire dans un centre spécialisé.
2 Malformations Pulmonaires Congénitales (MPC) :
- Divers types : Malformations Adénomatoïdes Kystiques Pulmonaires (MAKP), séquestrations pulmonaires, atrésie bronchique, kyste neurentérique.
- Diagnostic : L’échographie est essentielle pour l’évaluation du retentissement local, régional et général des MPC. Échogénicité, topographie et caractéristiques des lésions sont notées à chaque examen.
- Évolution : Les MAKP et séquestrations connaissent une croissance jusqu’à 30–32 semaines d’aménorrhée (SA), pour, le plus souvent, stagner ou régresser par la suite.
- Facteurs Prédictifs : Le CVR (Congenital pulmonary malformation volume ratio) diminue avec l’âge gestationnel.
- Syndrome de Pallister-Killian (SPK) :
- Diagnostic: L’examen de la face est aujourd’hui plus accessible grâce à l’avènement de l’échographie 3D.
- Le SPK est caractérisé par un phénotype facial particulier qui comprend un petit nez avec parfois une agénésie des os propres du nez, une lèvre supérieure épaisse (lèvre de Pallister) et un profil plat.
- Autres Pathologies Thoraciques Fœtales :
- Chylothorax : Définition et incidence, prise en charge prénatale.
Idées/Faits Importants
- L’importance de l’échographie : L’échographie est un outil essentiel pour le diagnostic prénatal et l’évaluation des anomalies thoraciques fœtales.
- Le LHR comme indicateur pronostique : La mesure du LHR (Lung-to-Head Ratio) est un outil pronostique important pour les HCD. Idéalement, la surface pulmonaire mesurée controlatérale à la HCD doit être proche de la sonde d’échographie et donc le fœtus placé dos antérieur. Pour éviter les cônes d’ombres liés aux côtes, la sonde d’échographie doit être parallèle aux côtes du fœtus, et donc, un maximum de 2 côtes doit être visible. L’opérateur sera sensible à la visualisation correcte des contours pulmonaires afin de s’assurer de la bonne position des calipers et s’aidera des images en dynamique pour bien distinguer la limite du poumon de la paroi de l’oreillette adjacente.
- La classification de Cordier pour la position de l’estomac : La classification de Cordier de la position de l’estomac est un indicateur pronostique pour les HCD gauches.
- Le rôle de l’IRM : L’IRM thoracique fœtale est utilisée pour évaluer le volume pulmonaire et le volume hépatique dans les HCD.
- Des facteurs prénataux influencent la morbidité gastro-intestinale : La position de l’estomac fœtal est le seul prédicteur de la morbidité gastro-intestinale (GIM) à 2 ans.
Bibliographie

Cet article traite du chylothorax congénital, un épanchement pleural fœtal pouvant être idiopathique ou secondaire à une pathologie sous-jacente. L’auteur analyse les différentes stratégies diagnostiques et thérapeutiques disponibles en prénatal pour optimiser la prise en charge et améliorer le pronostic néonatal.
L’hydrothorax fœtal peut être primitif ou secondaire et a une incidence estimée entre 1/10 000 et 1/15 000 grossesses. Le diagnostic repose principalement sur l’échographie, qui met en évidence un épanchement pleural uni ou bilatéral, parfois associé à un hydramnios et une compression pulmonaire. Le chylothorax est confirmé par analyse du liquide pleural après ponction, en identifiant un taux de triglycérides > 1,1 mmol/L et une prédominance de lymphocytes (>80 %).
Stratégies de prise en charge :
Approche conservatrice :
Indiquée pour les épanchements modérés sans signes de compression sévère.
Taux de survie rapportés entre 73 et 100 %.
Ponction pleurale :
Peut être réalisée à visée diagnostique et thérapeutique.
Utilisée pour soulager la compression thoracique et évaluer la capacité pulmonaire.
Nécessite parfois des ponctions itératives, avec un risque d’anasarque et d’hypoprotéinémie.
Shunt pleuro-amniotique :
Drainage permanent via un cathéter pigtail sous guidage échographique.
Permet une meilleure expansion pulmonaire et réduit la récidive de l’épanchement.
Taux de survie postnatale variant entre 50 et 90 %, dépendant de la présence d’un hydrops.
Pleurodèse intra-utérine :
Intervention rare en raison du manque de recul sur son efficacité en médecine fœtale.
Peu d’études cliniques validant cette technique pour le traitement du chylothorax prénatal.
Pronostic et recommandations :
Le pronostic dépend principalement de l’évolution de l’épanchement et de la présence ou non d’un hydrops. Une prise en charge précoce par shunt pleuro-amniotique est recommandée dans les formes sévères pour éviter une hypoplasie pulmonaire et améliorer l’adaptation respiratoire néonatale. L’article conclut que la surveillance échographique rapprochée et la gestion multidisciplinaire sont essentielles pour optimiser la survie des nouveau-nés atteints de chylothorax congénital
La hernie diaphragmatique congénitale (HDC) est une malformation sévère associée à une hypoplasie pulmonaire et une hypertension artérielle pulmonaire. Cet article explore les avancées récentes en imagerie prénatale, les facteurs pronostiques et les perspectives thérapeutiques in utero pour améliorer les chances de survie néonatale.
1. Dépistage et imagerie prénatale
60 % des HDC sont détectées par échographie dès le 2ᵉ trimestre.
Le diagnostic repose sur l’identification d’une déviation cardiaque, d’une position anormale de l’estomac et/ou d’une hernie hépatique.
L’IRM fœtale est un complément essentiel à l’échographie pour quantifier le volume pulmonaire et évaluer la gravité de l’atteinte.
Une évaluation génétique est recommandée, car 40 % des cas sont associés à des anomalies chromosomiques ou syndromiques.
2. Facteurs pronostiques et classification de la sévérité
Lung-to-Head Ratio (LHR) : indicateur clé du développement pulmonaire.
LHR < 25 % → mauvais pronostic.
LHR > 45 % → meilleur taux de survie.
Position du foie : un foie intrathoracique est un facteur aggravant, réduisant la probabilité de survie.
Présence d’hypertension pulmonaire persistante (HPPN) : prédiction encore limitée malgré les progrès en imagerie Doppler.
3. Approches thérapeutiques prénatales et gestion périnatale
Occlusion trachéale fœtoscopique (FETO) : intervention visant à stimuler la croissance pulmonaire en bloquant l’évacuation du liquide pulmonaire.
Classification des fœtus candidats à une intervention in utero basée sur les données échographiques et IRM.
Planification de l’accouchement dans un centre tertiaire spécialisé pour maximiser les chances de survie postnatale.
4. Perspectives et axes de recherche
L’amélioration des algorithmes de prédiction de la sévérité reste une priorité.
Des thérapies alternatives, comme le sildénafil ou les traitements ciblant l’hypertension pulmonaire néonatale, sont à l’étude.
Conclusion
Grâce aux avancées en imagerie et en thérapie prénatale, la prise en charge des fœtus atteints de HDC a considérablement évolué. L’identification précoce des facteurs de risque et l’optimisation des stratégies thérapeutiques permettent d’améliorer les perspectives de survie et de réduire la morbidité chez les nouveau-nés.
Ce chapitre est dédié à l’évaluation échographique des pathologies thoraciques fœtales et couvre des conditions comme :
- Les maladies adénomatoïdes kystiques pulmonaires (MAKP)
- La séquestration pulmonaire
- Les kystes bronchogéniques
- Les atrésies bronchiques
- L’hernie diaphragmatique
L’auteur décrit les critères échographiques essentiels permettant de différencier ces pathologies et insiste sur la nécessité d’un suivi échographique rapproché, notamment entre 28 et 30 SA, période où les lésions peuvent évoluer. Un tableau récapitulatif des anomalies thoraciques est inclus, avec leur impact sur la croissance pulmonaire et les effets de compression médiastinale.
L’importance du Doppler couleur et de l’IRM pour les cas complexes est également soulignée. L’ouvrage recommande une approche multidisciplinaire pour la prise en charge des grossesses compliquées par des malformations thoraciques.
Le syndrome de Pallister-Killian (SPK) est une anomalie chromosomique rare due à une tétrasomie 12p en mosaïque, souvent associée à un phénotype polymalformatif. Son diagnostic prénatal est complexe, car les signes échographiques sont variés et parfois peu spécifiques. Cette étude multicentrique rétrospective vise à comparer les données échographiques prénatales et fœtopathologiques de six cas confirmés par analyse cytogénétique.
Méthodes
Recueil des cas par un appel à collaboration auprès des membres de la Société de Fœtopathologie Française (SOFFOET).
Analyse des données échographiques prénatales, complétée par une autopsie fœtale après interruption médicale de grossesse.
Revue de la littérature pour comparer les anomalies morphologiques décrites dans le SPK.
Résultats
Hernie diaphragmatique présente dans un seul des six cas, bien que souvent associée au SPK.
Dysmorphie cranio-faciale (5 cas/6) : hyperplasie frontale, philtrum long, hypertélorisme.
Micromélie et anomalies des membres (3 cas/6) : fémur court, brachydactylie.
Absence de retard de croissance intra-utérin, avec même une tendance à la macrosomie (+2,67 DS selon certaines études).
Épanchement pleural et malformations cardiaques détectés dans certains cas.
Discussion et perspectives
L’étude confirme que l’échographie prénatale ne permet pas toujours un diagnostic définitif du SPK. L’absence systématique de hernie diaphragmatique dans cette série remet en question la perception de cette anomalie comme un marqueur constant du SPK. Les auteurs soulignent l’importance d’associer l’échographie 3D et le caryotype moléculaire (CGH array) pour affiner le diagnostic.
Conclusion
Certaines associations malformatives (dysmorphie faciale, micromélie, absence de retard de croissance) doivent éveiller la suspicion d’un SPK même en l’absence de hernie diaphragmatique. L’article recommande un recours systématique au caryotype moléculaire pour poser un diagnostic fiable et éviter les faux négatifs liés au mosaïcisme faible
Cet article passe en revue les avancées récentes dans le diagnostic prénatal, l’imagerie et la gestion de la hernie diaphragmatique congénitale (HDC), une anomalie caractérisée par un défaut de fermeture du diaphragme, entraînant la migration des organes abdominaux dans la cavité thoracique et perturbant le développement pulmonaire.
1. Diagnostic prénatal et imagerie
L’HDC est détectée chez 60 à 70 % des fœtus lors du dépistage échographique du 2ᵉ trimestre.
L’échographie montre une déviation cardiaque, une hernie du foie et un volume pulmonaire réduit.
L’IRM prénatale est utilisée pour affiner l’évaluation du volume pulmonaire total et de la position du foie.
Des tests génétiques avancés permettent d’identifier des cas syndromiques d’HDC, représentant jusqu’à 40 % des diagnostics.
2. Facteurs pronostiques et classification de la sévérité
L’estimation du Lung-to-Head Ratio (LHR) permet de prédire le risque d’hypoplasie pulmonaire :
LHR > 45 % : bon pronostic
LHR < 25 % : risque de complications sévères
La position du foie et de l’estomac sont également des marqueurs de sévérité, bien que leur valeur prédictive soit encore débattue.
L’hypertension pulmonaire persistante (HPPN) demeure le principal facteur influençant la survie néonatale, mais sa prédiction en prénatal reste un défi.
3. Approches thérapeutiques prénatales
L’occlusion trachéale fœtoscopique (FETO) est une procédure expérimentale qui vise à stimuler la croissance pulmonaire en bloquant l’évacuation du liquide pulmonaire.
Le FETO est actuellement évalué dans le cadre de l’essai clinique TOTAL, une étude randomisée internationale.
D’autres approches en cours d’évaluation incluent l’administration maternelle de sildénafil, un vasodilatateur visant à réduire l’hypertension pulmonaire néonatale.
4. Gestion périnatale et postnatale
L’accouchement doit être planifié dans un centre tertiaire spécialisé, avec une prise en charge néonatale standardisée.
Les survivants nécessitent un suivi à long terme, car des complications telles que le reflux gastro-œsophagien, des troubles de l’alimentation et un retard de croissance sont fréquents.
Conclusion
L’amélioration du diagnostic prénatal et des techniques d’imagerie a permis une meilleure individualisation du pronostic des fœtus atteints d’HDC. Bien que des avancées majeures aient été faites avec des stratégies comme le FETO, des recherches sont encore nécessaires pour améliorer la prédiction de l’hypertension pulmonaire néonatale et développer de nouvelles options thérapeutiques
Cet article fournit une approche méthodique pour la réalisation de l’échographie diagnostique d’une hernie diaphragmatique congénitale (HDC). L’HDC est une anomalie congénitale sévère, caractérisée par le passage d’organes abdominaux dans la cavité thoracique, induisant une hypoplasie pulmonaire et une hypertension artérielle pulmonaire. L’article détaille les signes échographiques essentiels, les outils de pronostic et les recommandations de prise en charge.
1. Diagnostic échographique et signes d’alerte
Visualisation inhabituelle de l’estomac dans le thorax, particulièrement en cas de HDC gauche.
Déviation du cœur vers le côté opposé avec compression des cavités cardiaques.
Présence du foie dans le thorax, particulièrement dans les hernies droites, rendant leur diagnostic plus difficile.
Absence ou image anormale de la coupole diaphragmatique en coupe parasagittale.
2. Évaluation des malformations associées
La HDC est associée à des anomalies génétiques et morphologiques dans 35 % des cas.
Une échocardiographie fœtale est indispensable en raison du risque élevé de malformations cardiaques (défauts septaux, anomalies conotroncales).
Amniocentèse et analyse chromosomique recommandées, notamment pour exclure la trisomie 18 et le syndrome de Pallister-Killian.
3. Facteurs pronostiques et outils d’évaluation
Lung-to-Head Ratio (LHR) : estimation du degré d’hypoplasie pulmonaire. Un LHR inférieur à 0,6 est associé à un très mauvais pronostic.
Position du foie : un foie intrathoracique est un facteur de sévérité.
IRM fœtale : utilisée pour évaluer le volume pulmonaire total et améliorer la prédiction de la survie néonatale.
4. Options thérapeutiques prénatales et prise en charge périnatale
Thérapie fœtale par occlusion trachéale intra-utérine (FETO), réalisée entre 28 et 30 SA, pour stimuler la croissance pulmonaire en cas de pronostic défavorable.
Accouchement en centre de référence (niveau III) avec service de réanimation et chirurgie néonatale.
Conclusion
L’échographie est un outil central pour le diagnostic et l’évaluation pronostique de la HDC. L’article met en avant la nécessité d’un protocole standardisé pour évaluer la sévérité de l’atteinte pulmonaire et les malformations associées afin d’optimiser la prise en charge périnatale et améliorer les chances de survie néonatale
Le tératome médiastinal fœtal est une tumeur rare mais potentiellement mortelle, pouvant être confondue avec d’autres lésions kystiques pulmonaires congénitales en échographie prénatale. Cette étude de cas décrit un tératome médiastinal immature associé à un hydrops fœtal sévère, initialement mal diagnostiqué comme une malformation kystique adénomatoïde pulmonaire (CCAM) en raison de sa structure mixte.
- Présentation du cas et diagnostic prénatal
- Une patiente de 31 ans (G2P2) est référée pour évaluation d’un hydrops fœtal sévère à 23 semaines de gestation.
- L’échographie met en évidence :
- Une masse mixte kystique et solide dans le médiastin.
- Une déviation cardiaque vers le côté gauche, mimant une CCAM.
- Des effusions pleurales et ascites massives, signes évocateurs d’un hydrops.
- L’IRM fœtale n’a pas été réalisée, et le diagnostic initial est resté incertain.
- Conséquences fœtales et décision obstétricale
- L’évolution rapide de l’hydrops a conduit à une interruption médicale de grossesse à 24 semaines, après consentement parental.
- L’autopsie révèle :
- Une masse bien encapsulée de 6,1 × 4,4 × 2,8 cm comprimant sévèrement le cœur et les poumons.
- Une hypoplasie pulmonaire et thymique majeure.
- Une hémorragie intraventriculaire cérébrale, conséquence d’une insuffisance cardiaque fœtale.
- Discussion et implications diagnostiques
- Le tératome médiastinal fœtal peut être mal interprété comme une malformation pulmonaire kystique ou une hernie diaphragmatique en échographie prénatale.
- L’évaluation Doppler aurait permis d’améliorer la détection en analysant l’irrigation vasculaire de la masse.
- La compression cardiaque et vasculaire par la tumeur entraîne une insuffisance cardiaque et un hydrops, principaux facteurs de mauvais pronostic.
- En cas de diagnostic prénatal précoce, des interventions fœtales expérimentales (drainage de la tumeur, résection intra-utérine) pourraient être envisagées.
Conclusion
Le tératome médiastinal fœtal est une pathologie rare et difficile à diagnostiquer en prénatal. Cet article met en évidence l’importance d’un diagnostic différentiel précis via une échographie de haute résolution et une évaluation Doppler, pour éviter les erreurs d’interprétation et mieux anticiper la prise en charge postnatale.
Les malformations pulmonaires congénitales (MPC) sont généralement détectées lors des échographies prénatales. Si la plupart des nouveau-nés atteints sont asymptomatiques à la naissance, certains développent une détresse respiratoire sévère, nécessitant une prise en charge immédiate, incluant l’assistance ventilatoire et la chirurgie néonatale. Cependant, les facteurs prédictifs de détresse respiratoire néonatale restent mal définis. Cette étude vise à identifier les marqueurs échographiques prénataux pouvant prédire ces complications respiratoires postnatales.
Méthodes
Étude basée sur le registre multicentrique RespiRare, collectant des données sur les enfants nés avec des pathologies respiratoires rares en France (2008-2013).
Sélection des cas avec un diagnostic prénatal de lésions pulmonaires hyperechogènes et/ou kystiques.
Analyse de la corrélation entre les paramètres échographiques prénataux et les symptômes respiratoires néonataux.
Résultats
89 enfants inclus, parmi lesquels 22 (25 %) ont présenté des difficultés respiratoires à la naissance.
12 nouveau-nés (13 %) ont souffert d’une détresse respiratoire sévère, nécessitant oxygénothérapie et ventilation assistée.
Plusieurs paramètres prénataux ont été significativement associés au risque de détresse respiratoire :
Déplacement médiastinal (p = 0,0003)
Hydramnios (p = 0,05)
Ascite fœtale (p = 0,0005)
Surface maximale de la malformation prénatale (p = 0,001)
Rapport volume-malformation pulmonaire/volume fœtal (CVR) > 0,84 (p = 0,001)
Conclusions
Les résultats de cette étude montrent que la présence d’un hydramnios, d’une ascite et d’un CVR > 0,84 sont des facteurs de risque majeurs de complications respiratoires à la naissance. Les nouveau-nés atteints doivent être pris en charge dans un centre de soins intensifs néonatals afin d’optimiser leur prise en charge immédiate et réduire la morbidité associée.
Les lésions pulmonaires hyperechogènes fœtales sont fréquemment détectées en échographie prénatale, mais leur étiologie exacte et leur signification clinique restent mal définies. Cette étude vise à évaluer la corrélation entre les diagnostics prénataux et postnataux afin d’améliorer la prise en charge périnatale et le conseil aux parents.
1. Méthodes
Étude rétrospective portant sur 75 cas diagnostiqués entre 2009 et 2018.
L’évaluation prénatale a été réalisée par échographie fœtale et Doppler couleur.
L’analyse postnatale repose sur la tomodensitométrie (CT-scan) et, dans certains cas, l’examen histologique après résection chirurgicale.
2. Résultats principaux
Trois diagnostics prénataux les plus fréquents :
Séquestration bronchopulmonaire (BPS) : 24 cas (32 %)
Malformations pulmonaires kystiques congénitales (PCM) : 19 cas (25 %)
Emphysème lobaire congénital (CLE) : 15 cas (20 %)
Une déviation médiastinale était présente chez 18 fœtus (24 %).
Taux de concordance diagnostique prénatal-postnatal :
Détection de l’artère systémique d’alimentation (caractéristique du BPS) : 90 % de précision.
Détection d’une composante kystique : 76,5 % de précision.
16 nouveau-nés avec une simple déviation médiastinale isolée étaient asymptomatiques à la naissance.
7 nouveau-nés ont développé une détresse respiratoire non anticipée lors du diagnostic prénatal.
3. Discussion et implications cliniques
Les lésions pulmonaires hyperechogènes sont une entité hétérogène et peuvent correspondre à plusieurs malformations pulmonaires congénitales.
Si la détection d’une artère systémique permet de confirmer un BPS avec une forte fiabilité, la prédiction des lésions kystiques reste plus imprécise.
L’évolution des lésions après la naissance est variable, et certaines anomalies considérées comme graves en prénatal se révèlent bénignes postnatales.
4. Conclusion
L’étude met en évidence que, malgré les progrès de l’imagerie prénatale, la prédiction précise des lésions pulmonaires fœtales reste un défi. Si certaines anomalies, comme le BPS, peuvent être bien identifiées, d’autres restent difficiles à classifier avant la naissance. Une évaluation rigoureuse et un suivi postnatal systématique restent donc essentiels pour optimiser la prise en charge des nouveau-nés atteints.
Les malformations pulmonaires congénitales (MPC) sont des anomalies détectées en prénatal par échographie, souvent sous la forme de lésions hyperechogènes ou kystiques. Cependant, l’évolution naturelle de ces lésions et leur impact sur le pronostic fœtal restent mal compris. L’objectif de cette étude est d’analyser les modifications du volume des MPC pendant la grossesse et d’examiner leur corrélation avec les risques de compression fœtale.
1. Méthodes
Étude prospective multicentrique basée sur la cohorte française MALFPULM, recrutant 176 femmes enceintes entre 2015 et 2016.
Suivi échographique rigoureux avec 579 échographies analysées entre le diagnostic et l’accouchement.
Analyse de la corrélation entre le volume des malformations pulmonaires et l’apparition de signes de compression (déplacement médiastinal, hydrops, ascite, polyhydramnios).
2. Résultats principaux
Une diminution significative du ratio de volume des MPC (CVR) avec l’âge gestationnel (p < 0,001).
Différences selon le phénotype échographique :
Les lésions kystiques/mixées présentent une réduction progressive et linéaire du CVR.
Les lésions hyperechogènes montrent d’abord une augmentation du CVR jusqu’à 27 SA, suivie d’une diminution marquée.
Le CVR initial élevé (>0,4 cm²) est un facteur de risque de compression fœtale.
45 % des fœtus présentaient un déplacement médiastinal, et 1,7 % ont développé un hydrops sévère.
3. Discussion et implications cliniques
L’évolution du volume des MPC est phénotype-dépendante, ce qui peut influencer la stratégie de surveillance et de traitement.
Un CVR élevé dès le premier diagnostic échographique augmente le risque de complications intra-utérines, nécessitant une surveillance rapprochée.
Ces résultats suggèrent que le CVR mesuré précocement peut aider à prédire les risques fœtaux et optimiser la prise en charge périnatale.
4. Conclusion
Cette étude met en évidence des différences importantes entre les malformations kystiques et hyperechogènes en termes de croissance et de résolution spontanée. L’utilisation du CVR comme biomarqueur pronostique pourrait permettre d’améliorer la stratification du risque et les recommandations pour la prise en charge des MPC.